этилхлорид
ЭТИЛХЛОРИД (хлорэтан, хлористый этил) C2H5Cl
мол. м. 64,52; бесцветный газ; т. пл. −138,3 °C, т. кип. 12,27 °C; 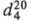 0,8978, плотн. по воздуху 2,23;
0,8978, плотн. по воздуху 2,23; 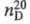 1,3676; длины связей 1,77 нм (С — С1), 1,55 нм (С — С); энергии связей (кДж/моль): 406,43 (С — Н), 336,4 (С — С1) 371,1 (С —С); tкрит 187,2 °C, pкрит 5,27 МПа, dкрит 0,33 г/см3 ; η (мПа∙с) жидкости 0,502 ( −40 °C), 0,330 (0 °C), 0,155 (100 °C), пара 6,88 ( −60 °C), 9,11 (0 °C), 12,08 (100 °C), 22,25 (400 °C); γ (мН/м) 24,2 ( −40 °C), 21,6 (0 °C), 19,5 (20 °C), 9,4 (100 °C); μ 6,0∙10−30 Кл∙м; давление пара (кПа) 1,3 ( −66,4 °C), 24,5 ( −20 °C), 60,7 (0 °C), 135 (20 °C), 1165 (100 °C), 5067 (180,5 °C);
1,3676; длины связей 1,77 нм (С — С1), 1,55 нм (С — С); энергии связей (кДж/моль): 406,43 (С — Н), 336,4 (С — С1) 371,1 (С —С); tкрит 187,2 °C, pкрит 5,27 МПа, dкрит 0,33 г/см3 ; η (мПа∙с) жидкости 0,502 ( −40 °C), 0,330 (0 °C), 0,155 (100 °C), пара 6,88 ( −60 °C), 9,11 (0 °C), 12,08 (100 °C), 22,25 (400 °C); γ (мН/м) 24,2 ( −40 °C), 21,6 (0 °C), 19,5 (20 °C), 9,4 (100 °C); μ 6,0∙10−30 Кл∙м; давление пара (кПа) 1,3 ( −66,4 °C), 24,5 ( −20 °C), 60,7 (0 °C), 135 (20 °C), 1165 (100 °C), 5067 (180,5 °C); 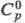 [кДж/(кг∙К)] жидкости 1,474 ( −40 °C), 1,574 (20 °C), 2,018 (100 °C), пара 0,90 (0 °C), 1,130 (100 °C), 1,821 (500 °C);
[кДж/(кг∙К)] жидкости 1,474 ( −40 °C), 1,574 (20 °C), 2,018 (100 °C), пара 0,90 (0 °C), 1,130 (100 °C), 1,821 (500 °C); 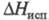 (кДж/кг) 418,7 ( −20 °C), 379,1 (12,27 °C), 276,3 (100 °C);
(кДж/кг) 418,7 ( −20 °C), 379,1 (12,27 °C), 276,3 (100 °C); 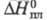 69,04 кДж/кг,
69,04 кДж/кг, 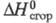 −1326 кДж/моль,
−1326 кДж/моль, 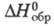 −105,1 кДж/моль;
−105,1 кДж/моль; 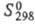 274,9 Дж/(моль∙К), коэф. теплопроводности [Вт(м∙К)] жидкости 0,1569 ( −40 °C), 0,1301 (0 °C), 0,090 (100 °C), пара 0,00929 (0 °C), 0,01657 (100 °C), 0,03347 (300 °C);
274,9 Дж/(моль∙К), коэф. теплопроводности [Вт(м∙К)] жидкости 0,1569 ( −40 °C), 0,1301 (0 °C), 0,090 (100 °C), пара 0,00929 (0 °C), 0,01657 (100 °C), 0,03347 (300 °C); 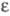 жидкости 10,43 (0 °C), пара 1,0132 (20 °C).
жидкости 10,43 (0 °C), пара 1,0132 (20 °C).
Э. хорошо раств. в органических растворителях; растворимость в воде (% по массе): 0,450 (0 °C), 0,574 (20 °C); растворимость воды в Э. 0,07 (0 °C), 0,36 (50 °C); образует азеотропную смесь с водой (т. кип. 11,8 °C, 99,6% Э.).
Э. реагирует с хлором в жидкой фазе в присутствии инициаторов или в газовой фазе в присутствии катализаторов (Al2O3, силикагель и др.) с образованием смеси 1,1- и 1,2-дихлорэтанов, с понижением температуры возрастает выход 1,1-дихлорэтана. С бромом при 100 °C в присутствии Fe дает хлорбромэтан. При действии спиртовой щелочи в газовой фазе в объеме (выше 350 °C) или в присутствии катализаторов (Al2O3, силикагель, пемза и др.) дегидрохлорируется в этилен. Гидролизуется в присутствии щелочей до C2H5OH и (C2H5)2O. В присут. металлов VIII гр. восстанавливается до этана; при 300–350 °C в избытке водорода — до метана; в присутствии Na превращается в бутан, с магнием дает реактив Гриньяра; при окислении образуются CO2, HCl и H2O. Э. вступает в реакции обмена атома С1 на NH2, CN и др.
Получают Э. гидрохлорированием этилена, как правило, в жидкой фазе в присутствии AlCl3 при −10 °C. Образующийся Э. промывают, нейтрализуют, сушат и ректифицируют. Э. получают также взаимод. C2H5OH с HCl либо хлорированием этана в газовой фазе в объеме.
Применяют Э. в производстве Pb(C2H5)4, этилцеллюлозы, кремнийорг. соед.; Э. — растворитель жиров, масел, прир. смол, восков и др.; средство для наружного наркоза.
Э. горюч, взрыво- и пожароопасен; т. всп. −50 °C (в закрытом приборе), −43 °C (в открытом), т. самовоспл. 494 °C; КПВ 3,8–15,4% (по объему), ПДК в воздухе рабочей зоны 50 мг/м3.
Производство Э. в США 69 млн. т в год (1988).
Лит.: Промышленные хлорорганические продукты. Справочник, М., 1978, с. 44–52.
Ю. А. Трегер
Значения в других словарях
- Этилхлорид — Монохлорэтан, C2H5Cl; бесцветная легко летучая жидкость с эфирным запахом, tkип 12,5°С, tпл — 140,85°С, плотность 0,903 г/см3 (15°С); плохо растворим в воде, смешивается с большинством органических растворителей. Большая советская энциклопедия
- этилхлорид — орф. этилхлорид, -а Орфографический словарь Лопатина
- этилхлорид — Этил/хлор/и́д/. Морфемно-орфографический словарь
- ЭТИЛХЛОРИД — ЭТИЛХЛОРИД (хлористый этил) — C2H5Cl, бесцветная легколетучая жидкость, tкип 12,27 °С. Применяется для получения тетраэтилсвинца и этилцеллюлозы; экстрагент жиров, эфирных масел; в медицине (под названием хлорэтил) средство для поверхностного местного обезболивания. Большой энциклопедический словарь
