этиловый спирт
ЭТИЛОВЫЙ СПИРТ (этанол, метилкарбинол, винный спирт) C2H5OH
мол. м. 46,069; бесцв. легкоподвижная жидкость с характерным запахом и жгучим вкусом; т. пл. −114,15 °C, т. кип. 78,39 °C; 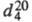 0,78927;
0,78927; 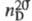 1,3611; tкрит 243,1 °C, pкрит 6,395 МПа, dкрит 0,275 г/см3;
1,3611; tкрит 243,1 °C, pкрит 6,395 МПа, dкрит 0,275 г/см3; 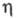 1,17 мПа∙с (20 °C); γ 231 мН/м (25 °C);
1,17 мПа∙с (20 °C); γ 231 мН/м (25 °C); 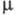 5,67∙10−30 Кл∙м (в бензоле); Cр (20 °C) 2,428 кДж/(кг∙К) (для жидкости), 1,197 кДж/(кг∙К) (для пара);
5,67∙10−30 Кл∙м (в бензоле); Cр (20 °C) 2,428 кДж/(кг∙К) (для жидкости), 1,197 кДж/(кг∙К) (для пара); 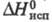 839,3 Дж/г;
839,3 Дж/г; 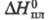 4,81 кДж/моль;
4,81 кДж/моль; 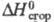 −29,68 кДж/г;
−29,68 кДж/г; 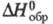 −234,8 кДж/моль (для пара);
−234,8 кДж/моль (для пара); 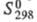 281,380 Дж/(моль∙К),
281,380 Дж/(моль∙К), 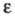 25,7 (20 °C).
25,7 (20 °C).
Э. с. смешивается во всех соотношениях с водой (свойства водных растворов Э. с. приведены в табл.), спиртами, диэтиловым эфиром, глицерином, хлороформом, ацетальдегидом, бензином и др.; образует азеотропные смеси с водой (95,6% по массе Э. с., т. кип. 78,15 оС); бензолом (32,4%, 68,24 °C); гексаном (21%, 58,7 °C); толуолом (68%, 75,65 °C); этилацетатом (30,8%, 71,8 °C) и др., а также тройные азеотропные смеси, напр. Э. с. — бензол — вода (содержание в % по массе соотв. 18,5–74,1–7,4, т. кип. 64,86 °C), Э. с. — дихлорэтан — вода (17-78–5, 66,7 °C). Э. с. горит бледно-голубым пламенем.
Химические свойства. Э. с. — типичный одноатомный алифатич. спирт. С металлами образует этилаты, напр. C2H5ONa, (C2H5О)3А1; с неорг. и орг. кислотами, ангидридами, галогенангидридами — сложные эфиры, напр. с H2SO4 этилсульфат C2H5ОSO3Н или диэтилсульфат (C2H5О)2SO2, с CH3COOH — этилацетат. Реакция с эпоксидами приводит к раскрытию кольца и образованию гидроксиэфиров, напр.:

СВОЙСТВА ВОДНЫХ РАСТВОРОВ ЭТИЛОВОГО СПИРТА
таблица в процессе добавления
Дегидратация Э. с. приводит к этилену или диэтиловому эфиру; дегидрирование — к ацетальдегиду; реакция с альдегидами и кетонами RR'CO — к ацеталям RR'C(OC2H5)2; с NaClO — к хлороформу (см. галоформная реакция), хлорирование — к хлоралю; взаимод. с NH3 — к моно-, ди- и триэтиламинам; реакция с POCl3 или SO2C12 в присутствии третичных аминов — к полным эфирам фосфорной или серной кислоты. При пропускании паров Э. с. над сложным катализатором при 380–400 °C образуется 1,3-бутадиен, при взаимодействии Э. с. с ацетиленом — винилэтиловый эфир C2H5ОСН = CH2.
Получение. В промышленности Э. с. получают анаэробным брожением углеводов растит. происхождения в присутствии дрожжей и гидратацией этилена. Перспективен способ получения Э. с. из синтез-газа: прямым синтезом из CO и H2 либо через метиловый спирт.
Сырьем для производства Э. с. служат пищевое растит. сырье, отходы деревообрабатывающей промышленности, сульфитные щелоки.
Сбраживание пищевого растит. сырья- наиб. древний способ получения Э. с., известный с доисторич. времен. Перед брожением сырье (сок плодово-ягодных культур, зерно, картофель, меласса — отход сахароварения) очищают, толстокожурное зерно дробят и разваривают 1–2 ч острым паром при давлении 0,4–0,5 МПа для разрушения клеточных оболочек. Крахмалсодержащее сырье перед подачей на брожение осахаривают ферментсодержащим препаратом (солодом или микробными ферментами) при 60 °C. При необходимости сырье подкисляют, добавляют водный раствор аммиака и фосфаты. Брожение происходит в присутствии дрожжей при 15–30 °C, длительность от 10–15 ч до 2–3 сут. Теоретич. выход Э. с. определяется уравнением реакции: C6H12O6 2C2H5OH + 2CO2; практич. выход 90–93%. Побочно при брожении образуются метанол, спирты C3-C5, глицерин, янтарная кислота, ацетальдегид, сложные эфиры и др. Реакц. смесь после брожения (бражку) очищают на ректификационных установках; остаток от перегонки (барда) идет на корм скоту. Расход пищ. сырья на получение 1 т Э. с.: картофеля 10–13 т, ячменя 4–5 т, пшеницы и кукурузы 3,5–4 т. О механизме спиртового брожения см. в ст. брожение.
2C2H5OH + 2CO2; практич. выход 90–93%. Побочно при брожении образуются метанол, спирты C3-C5, глицерин, янтарная кислота, ацетальдегид, сложные эфиры и др. Реакц. смесь после брожения (бражку) очищают на ректификационных установках; остаток от перегонки (барда) идет на корм скоту. Расход пищ. сырья на получение 1 т Э. с.: картофеля 10–13 т, ячменя 4–5 т, пшеницы и кукурузы 3,5–4 т. О механизме спиртового брожения см. в ст. брожение.
Гидролиз отходов деревообрабатывающей промышленности осуществляют водой в присутствии кислот либо солей, дающих кислую реакцию (см. гидролизные производства). Сбраживание полученных Сахаров и выделение Э. с. из бражки аналогичны вышеописанному. Из 1 т сухой хвойной древесины получают 130–160 кг Э. с. и до 120 кг сжиженной углекислоты. При комплексной переработке гидролизата получают также фурфурол, кормовые дрожжи, гипс, лигнин. Метод используют в основном в России. За рубежом применяют ограниченно из-за высокой себестоимости спирта.
Для получения Э. с. из сульфитных щелоков (отход производства целлюлозы методом сульфитной варки древесины) древесину обрабатывают раствором, содержащим 3–6% своб. SO2 и 2% SO2 в виде гидросульфитов щелочных или щел.-зем. металлов при 135 150 °C и повыш. давлении. При этом целлюлоза не растворяется, а в раствор сульфитных щелоков переходят сульфолигнин, олиго- и моносахариды, часть смол, формальдегид и др. Щелоки продувают паром или воздухом, нейтрализуют известковым молоком, отделяют от гипсового шлама и направляют на сбраживание. Выход Э. с. на 1 т переработанной древесины ок. 80 кг; побочно образуется до 60 кг белковых дрожжей и 600–700 г сульфолигнина.
Осн. пром. способ получения синтетич. Э. с. — прямая гидратация этилена; катализатор — ортофосфорная кислота на пористом носителе (силикагель, диатомит, кизельгур, пористые стекла и др.). В качестве побочных продуктов образуются: ацетальдегид, диэтиловый эфир, кретоновый альдегид, ацетон, спирты C3-C4, метилэтилкетон, низкомол. полиэтилен.
Технол. схема производства Э. с.: смесь этиленсодержащего газа и воды нагревают в системе теплообменников (в осн. за счет тепла, выходящего из реактора потока, а на последней ступени — печи огневого нагрева или паром высокого давления в теплообменнике) и подают в реактор — цилиндрич. аппарат, заполненный катализатором (для защиты от коррозии реактор футеруется медью). На выходе из реактора или после охлаждения потока до точки росы реакц. смесь нейтрализуют раствором щелочи. Поток охлаждают направляемым в реактор сырьем, на последней ступени — в водяном холодильнике. Э. с., непрореагировавшая вода и побочные продукты реакции конденсируются, водно-спиртовый раствор (содержание Э. с. ок. 13%) сепарируется от непрореагировавшего этилена и направляется на узел выделения и очистки. Этиленсодержащий газ отмывается от остатков спирта водой, смешивается со свежими порциями этилена и вновь направляется в реактор.
Очистка Э. с. включает все или некоторые из след. стадий: удаление из водно-спиртового раствора легкокипящих головных фракций (ацетальдегид, диэтиловый эфир, ацетон, кротоновый альдегид, легкие полимеры) экстрактивной дистилляцией с водой; ректификацию кубового продукта и получение спирта-сырца (90–94% Э, с.); гидрирование спирта-сырца при 100 °C в паровой (давление 0,1–0,2 МПа), чаще жидкой фазе (давление 1,5–2,5 МПа) на никельсодержащем катализаторе; окончат. ректификацию (95–96%-ный Э. с.). Спирт, очищенный по полной схеме, по качеству не уступает пищевому.
Отходы производства — высшие спирты (применяются как растворители), диэтиловый эфир (рециклизуется на стадию гидратации либо используется как товарный продукт) и полимеры этилена (сжигаются).
Метод получения синтетич. Э. с. сернокислотной гидратацией этилена, распространенный в 40-60-х гг. 20 в., полностью вытеснен прямой гидратацией этилена; это связано со сложностью защиты оборудования от коррозии, высоким расходом H2SO4 и большими энергозатратами, проблемами экологии.
Производство Э. с. и выбор метода определяются наличием сырьевой базы и соотношением цен на пищевые и нефтепродукты.
Абсолютирование Э. с. осуществляют перегонкой с третьим компонентом, образующим с Э. с. и водой азеотроп, напр. с бензолом или циклогексаном. Установка для абсолютирования состоит из 2 колонн. В первую ректификац. колонну в середину подается 92–95%-ный Э. с., а в верхнюю часть — бензол. С верха колонны отбирается смесь Э. с., бензола и воды, из куба — абсолютир. Э. с. (концентрация 99,9%). Смесь конденсируется, охлаждается и направляется в разделит. сосуд для расслаивания. Бензол возвращается в колонну абсолютирования, а водно-спиртовый раствор — на вторую ректификац. колонну, в которой выделяют 92–95%-ный Э. с., рециклизуемый в первую колонну.
Разработаны способы пром. абсолютирования Э. с. на мол. ситах, полупроницаемых мембранах, абсорбцией жидким CO2, сжиженными алкенами и др. Иногда абсолютирование ведут азеотропной перегонкой с бензиновыми фракциями, особенно в случаях, когда абсолютир. Э. с. используется как добавка к моторному топливу. В препаративных целях Э. с. абсолютируют CaCl2, CuSO4, мол. ситами и др.
Идентифицируют Э. с. физ.-хим. методами либо через фенилуретан, т. пл. 57 °C.
Применение. Э. с. — растворитель в лакокрасочной и фармацев-тич. промышленности, в производстве кинофотоматериалов, товаров радиоэлектроники и бытовой химии, ВВ и др. Сырье в производстве диэтилового эфира, хлороформа, тетраэтилсвинца, ацетальдегида, уксусной кислоты, этилацетата, этиламина, этилакрилатов, этилсиликатов и др. Э. с. из пищ. сырья часто используют для получения чистого этилена. Э. с. — компонент антифриза, топливо для реактивных двигателей. В ряде стран — компонент автомобильного топлива: повышает октановое число, сокращает расход бензина, снижает содержание вредных веществ в выхлопных газах. Содержание Э. с. в автомобильном топливе в зависимости от сырьевой базы составляет от 10% в США до полной замены бензина этанолом в Бразилии.
Для техн. целей часто используют денатурированный спирт (денатурат) — спирт-сырец, содержащий добавки красителя, окрашивающего Э. с. в сине-фиолетовый цвет, и спец. веществ, придающих ему неприятный запах и вкус; денатурат ядовит. В медицине Э. с. применяется для дезинфекции, как поверхностное сосудорасширяющее средство, коагулянт белка, в т. ч. при лечении ожогов. Значит. часть Э. с. идет на изготовление спиртных напитков.
Э. с. чрезвычайно гигроскопичен, при концентрации выше 70% (по объему) прижигает кожу и слизистые оболочки; при приеме внутрь угнетает центры торможения мозга, вызывает опьянение, при многократном употреблении — алкоголизм.
Легко воспламеняется, т. всп. 13 °C, т. самовоспл. 404 °C, пределы взрываемости: температурные 11–41 °C, концентрационные 3,6–19% (по объему), ПДК в атм. воздухе 5 мг/м3, в воздухе рабочей зоны 1000 мг/м3, ЛД50 9 г/кг (крысы, перорально).
Наиб. крупные производители Э. с. (тыс. т в год): Бразилия 7500 (1985), США 2700 (1986), Россия 1200 (1989), Великобритания 200 (1986), Япония 179 (1985).
Впервые Э. с. выделен из продуктов брожения в Италии в 11–12 вв. Абсолютир. Э. с. получил перегонкой водного раствора над поташом Т. Е. Ловиц (1796). В 1855 М. Бертло синтезировал Э. с. из этилена через этил серную кислоту. Производство синтетич. Э. с. началось с 1930 в США.
Лит.: Брунштейн Б. А., Клименко В. Л., Цыркин Е.Б., Производство спиртов из нефтяного и газового сырья, Л., 1964; Сапотницкий С. А., Использование сульфитных щелоков, 2 изд., М., 1965; Технология гидролизных производств, М., 1973; Стабников В. Н., Ройтер И. М., Процюк Т. Б., Этиловый спирт, М., 1976; Новые тенденции в производстве синтетического этилового спирта, М., 1981; Справочник по производству спирта. Сырье, технология и технохимконтроль, М., 1981.
Б. С. Боуден
Значения в других словарях
- Этиловый спирт — Этанол, винный спирт, C2H5OH; бесцветная подвижная жидкость с характерным запахом и жгучим вкусом; tпл — 114,15°С, tkип 78,39°С, плотность 0,794 г/см3; смешивается с водой, эфиром, ацетоном и многими другими органическими растворителями... Большая советская энциклопедия
- этиловый спирт — ЭТИЛОВЫЙ СПИРТ, винный спирт, непредельный одноатомный спирт. В лечебной практике применяют Э. с. 95%-ный (Spiritus aethylicus 95%, Spiritus vini 95%). Прозрачная бесцветная подвижная летучая жидкость с характерным запахом. Плотность 0,812—0,808. Ветеринарный энциклопедический словарь
- ЭТИЛОВЫЙ СПИРТ — ЭТИЛОВЫЙ СПИРТ, см. ЭТАНОЛ. Научно-технический словарь
- Этиловый спирт — (Spiritus aethylicus; синоним: винный спирт, Spiritus vini) В медицинской практике 70, 90 и 95% этиловый спирт применяют в качестве антисептического средства (Антисептические средства), 40% — для компрессов и растираний. Медицинская энциклопедия
- ЭТИЛОВЫЙ СПИРТ — ЭТИЛОВЫЙ СПИРТ (этанол — винный спирт) — С2Н5ОН, бесцветная жидкость с характерным запахом. Получается сбраживанием пищевого сырья, гидролизом растительных материалов и синтетически (гидратацией этилена). Большой энциклопедический словарь
- Этиловый спирт — См. Алкоголь, Винокурение, Спирты, Алкоголиметрия и Спирометрия. Энциклопедический словарь Брокгауза и Ефрона
