кадмий
КАДМИЙ (от греч. kadmeia — цинковая руда; лат. Cadmium) Cd
хим. элемент II гр. периодической системы, ат. н. 48, ат. м. 112,41. Прир. К. состоит из восьми стабильных изотопов: 106Cd (1,22%), 108Cd (0,88%), 110Cd (12,39%), 111Cd (12,75%), 112Cd (24,07%), 113Cd (12,26%), 114Cd (28,85%) и 116Cd (7,58%). Поперечное сечение захвата тепловых нейтронов для прир. смеси 29∙10−26 м2, для 113Cd 25∙10−25 м2. Конфигурация внеш. электронной оболочки 4d105s2; степень окисления +2, редко +1; энергии ионизации при последоват. переходе от Cd0 к Cd3+ соотв. 8,9939, 16,9085 и 37,48 эВ; сродство к электрону — 0,27 эВ; электроотрицательность по Полингу 1,7; атомный радиус 0,146 нм, ионный радиус (в скобках указано координац. число) Cd2+ 0,092 нм (4), 0,101 нм (5), 0,109 нм (6), 0,117 нм (7), 0,145 нм (12). Содержание К. в земной коре 1,35∙10−5% по массе, в воде морей и океанов 0,00011 мг/л. Известно неск. очень редких минералов, напр., гринокит CdS, oтавит CdCO3, монтепонит CdO. К. накапливается в сульфидных рудах, в первую очередь в сфалерите (0,01–5,0%), особенно в маложелезистом, а также в галените (до 0,02%), халькопирите (до 0,12%), пирите (до 0,02%), блеклых рудах и станнине (до 0,2%). Извлекается попутно при переработке свинцово-цинковых и медных руд. Общие мировые ресурсы К. оцениваются в 20 млн. т, промышленные — в 600 тыс. т.
Свойства. К. — серебристо-белый металл с гексагон. плотноупакованной кристаллической решеткой, а = 0,2979 нм, с = 0,5618 нм, z = 2, пространственная группа С6/mmm; т. пл. 321,1 °C, т. кип. 766,5 °C; плотн. 8,65 г/см3; С0p 26,0 Дж/(моль∙К); ΔH0пл 6,2 кДж/моль, ΔH0исп 99,6 кДж/моль; S0298 51,8 Дж/(моль∙К); уравнения температурной зависимости давления пара (в гПа): для твердого lgp = 10,173 — 5924Т + 0,172T2 + 0,642∙10−2lgT (298–595 К), для жидкого lgp = 11,47 — 5406T + 0,975Т2 (594–1040 К); температурный коэф. линейного расширения 29,0∙10−6 К−1 (273 K; теплопроводность 92,85 Вт/(м∙К) при 293 К; ρ 7∙10−6 Ом∙м, температурный коэф. ρ 4,0∙10−3 К−1 (0–100 °C). Ниже 0,519 К — сверхпроводник. Диамагнитен; магн. восприимчивость −0,176∙10−9 (20 °C). Стандартный электродный потенциал −0,403 В. Мягкий ковкий тягучий металл, хорошо вальцуется в листы, легко поддается полированию. Палочки К. при сгибании издают треск подобно олову. Твердость по Моосу 2, по Бринеллю (для отожженного образца) 200–275 МПа; модуль Юнга 63 ГПа; предел текучести 9,8 МПа; σраст 69 МПа; относительное удлинение 50% (20 °C). В сухом воздухе К. устойчив, во влажном на его поверхности медленно образуется тонкая пленка оксида, предохраняющая металл от дальнейшего окисления. На воздухе выше температуры плавления К. сгорает с образованием бурого CdO (см. кадмия оксид). Пары К. реагируют с парами воды с выделением водорода. Медленно взаимод. с минеральными кислотами (легче всего с HNO3) с образованием солей. Соли К. бесцветны. В растворах молекулы мн. солей, в частности галогенидов, сильно ассоциированы; растворы имеют слабокислую реакцию вследствие гидролиза. При действии растворов щелочей, начиная с pH 7–8, осаждаются гидроксосоли. К. восстанавливает NH4NO3 в конц. растворах до NH4NO2. Окисляется до Cd(II) растворами CuCl2, солей Fe(III). С растворами щелочей, в отличие от Zn, не взаимодействует. Выше температуры плавления с галогенами образует кадмия галогениды, с халькогенами — кадмия сульфид, кадмия селенид, кадмия теллурид. С H2, N2, С, Si и В не реагирует. Косвенными путями получены легко разлагающиеся при нагр. гидрид CdH2 и нитрид Cd3N2. При сплавлении К. с Р и As образуются соотв. фосфиды и арсениды составов Cd3Э2 и CdЭ2, с сурьмой - кадмия антимонид. Для К. характерно образование амминов и др. комплексных соединений. Сухие соли К. поглощают большие количества NH3 — до 6 молекул на 1 молекулу соли и более. Гидроксид Cd(OH)2 растворяется в растворах NH3 с образованием ионов [Cd(NH3)4]2+; при действии NH3 на растворы солей К. в зависимости от условий могут образовываться амминокомплексы, содержащие от 1 до 6 молекул аммиака; при кипячении растворов они разлагаются. Труднорастворимый цианид Cd(CN)2 с избытком цианидов щелочных металлов дает легкорастворимые комплексные цианиды типов M2[Cd(CN)4] и M4[Cd(CN)6]. Водные растворы амминов, комплексных цианидов, а также комплексов К. с орг. и смешанными лигандами используют в качестве электролитов при кадмировании — нанесении на поверхность металлических изделий слоя К. Кадмирование осуществляют также пиролизом кадмийорганических соединений. При растворении К. в расплаве его галогенидов образуется Со+ ; расплавы при этом приобретают красно-черную окраску. При добавлении к расплаву AlHal3 он становится желто-зеленым. В таких растворах обнаружен ион Cd22+. Выделено твердое желтое соед. Cd2[AlCl4]2, которое при действии воды диспропорционирует с образованием Cd0 и Cd2+. Ион Cd+ образуется также при анодной поляризации растворов CdCl2 в ацетамиде и при импульсном радиолизе водных растворов, содержащих Cd2+. Важнейшим соед. К. посвящены отдельные статьи, ниже приводятся сведения о некоторых других. Арсенид Cd3As2 — серые кристаллы с тетрагон. решеткой (а = 1,267 нм, с = 2,548 нм, z = 8, пространственная группа I41cd); т. пл. 721 °C; плотн. 6,21 г/см3; ΔH0пл 32,1 кДж/моль, ΔH0обр −92 кДж/моль; S0298 206,8 Дж/(моль∙К). Известны и др. полиморфные модификации. Устойчив на воздухе и к действию воды, кислотами медленно разлагается. Полупроводник; при 300 К ширина запрещенной зоны 0,425 эВ, подвижность электронов 18000 см2/(В∙с). Материал для магнеторезисторов, ИК детекторов, датчиков эффекта Холла и др. Фосфид Cd3P2 — серые кристаллы с тетрагон. решеткой (а = 0,8746 нм, с = 1,228 нм, z = 8, пространственная группа P42/nmс); т. пл. 742 °C (с разл.); плотн. 5,60 г/см3; ΔH0обр −155,2 кДж/моль. Устойчив на воздухе и в воде, кислотамй разлагается, с конц. HNO3 реагирует со взрывом. Полупроводник; при 300 К ширина запрещенной зоны 0,52 эВ, подвижность электронов 1500–3600 cм2/(В∙с), концентрация носителей тока (3–6)∙1017 см−3. Получают сплавленисм Р и Cd или их взаимод. в парах. Перспективный лазерный и полупроводниковый материал. Известны также CdP2, CdP4, Cd7P10 и Cd6P7. Карбонат CdCO3 осаждается из растворов солей К. при действии карбонатов или гидрокарбонатов щелочных металлов и аммония; аморфный осадок содержит примесь гидроксокарбонатов. Безводный карбонат кристаллизуется в ромбоэдрич. решетке типа кальцита (а = 0,6112 нм, α = 47,4°, z = 2, пространственная группа 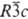 ); плотн. 5,02 г/см3; ΔH0обр −755 кДж/моль; S0298 97 Дж/(моль∙К). Мало раств. в воде (2,76∙10−6 % по массе при 20 °C), раств. в разб. кислотах, растворах NH3, солей аммония и цианидов щелочных металлов. Применяется для получения др. соед. К.
); плотн. 5,02 г/см3; ΔH0обр −755 кДж/моль; S0298 97 Дж/(моль∙К). Мало раств. в воде (2,76∙10−6 % по массе при 20 °C), раств. в разб. кислотах, растворах NH3, солей аммония и цианидов щелочных металлов. Применяется для получения др. соед. К.
Получение. Осн. источники К. — промежут. продукты цинкового производства: медно-кадмиевые кеки (осадки металлич. Cd, Cu и Zn, полученные после очистки растворов ZnSO4 действием цинковой пыли; содержат 2–12% К.), пуссьеры (летучие фракции при дистилляц. получении Zn; 0,7–1,1% К.), летучие фракции, выделенные при ректификац. очистке Zn (до 40% К.). К. извлекают также из пылей свинцовых (содержат 0,5–5% К.) и медеплавильных (0,2–0,5% К.) заводов. Пыли обычно обрабатывают конц. H2SO4, а затем выщелачивают водой; из растворов К. осаждают в виде кека вместе с медью. Из медно-кадмиевых кеков и др. продуктов с высоким содержанием К. его обычно выщелачивают H2SO4 при одновременной аэрации воздухом; процесс ведут в присутствии окислителя — марганцевой руды или оборотного марганцевого шлама из электролизных ванн. Из растворов одно- или двукратным осаждением цинковой пылью выделяют кадмиевую губку; растворяют губку в H2SO4, очищают раствор от примесей действием ZnO или Na2CO3, методами ионного обмена и др. К. выделяют электролизом на алюминиевых катодах либо цементацией на цинке (вытеснением цинком Cd0 из растворов CdSO4) с использованием центробежных реакторов-сепараторов. Рафинирование металлич. К. обычно заключается в переплавке металла под слоем щелочи (для удаления Zn и Pb), иногда с добавлением Na2CO3, обработке расплава алюминием (для удаления Ni) и NH4Cl (для удаления Tl). К. высокой чистоты получают электролитич. рафинированием с промежут. очисткой электролита (ионным обменом, экстракцией и др.), ректификацией металла (обычно при пониж. давлении), зонной плавкой или др. кристаллизац. методами. Сочетанием этих способов получают К. с содержанием осн. примесей (Zn, Cu и др.) 10−5% по массе. Для очистки К. могут быть также использованы методы электропереноса в жидком К., электрорафинирования в расплаве NaOH, амальгамного электролиза. При сочетании зонной плавки с электропереносом наряду с очисткой может происходить и разделение изотопов К.
Определение. Качественно К. обнаруживают после отделения др. элементов по образованию желтого осадка CdS при действии H2S, с использованием капельных реакций с динитро-n-дифенилкарбазидом (фиолетово-синее окрашивание) или реактивами группы кадионов (желтое или розовое окрашивание). Количественно определение осуществляют: комплексонометрически — с использованием в качестве индикаторов эриохрома Т (pH 10), ксиленолового оранжевого (pH 4,5) и др.; гравиметрически — осаждением из кислых растворов в виде CdS (с послед. переводом в CdSO4) или в виде комплекса с β-нафтохинолином (C13H9NH)2CdI4; полярографически. Для определения малых концентраций К. применяют флуоресцентные, фотометрические, нейтронно-активационный, атомно-абсорбционный и др. методы.
Применение. К. в основном (ок. 40%) используют для нанесения антикоррозионных покрытий на металлы. Высокая пластичность таких покрытий обеспечивает герметичность резьбовых соединений. Кадмиевые электроды применяют в аккумуляторах (~ 20% К.), нормальных элементах Вестона. Используют К. для получения пигментов (~ 20%) и спец. припоев, полупроводниковых материалов, стабилизаторов (~ 10%) пластмасс (напр., поливинилхлорида), как компонент антифрикционных, легкоплавких и ювелирных сплавов, для изготовления регулирующих и аварийных стержней ядерных реакторов. Мировое производство К. (без СССР) ок. 15000 т/год (1980). Осн. производители -Япония, США, Бельгия, Канада, ФРГ, Австралия, Перу. Пары К. и его соед. токсичны, причем К. может накапливаться в организме. Симптомы острого отравления солями К. рвота и судороги. Растворимые соед. К. после всасывания в кровь поражают центр. нервную систему, печень и почки, нарушают фосфорно-кальциевый обмен. Хронич. отравление приводит к анемии и разрушению костей. ПДК (рекомендованная) в сточных водах для солей 0,1 мг/л, в питьевой воде 0,01 мг/л. К. открыл Ф. Штромейер в 1917
Лит.: Дзлиев И. И., Металлургия кадмия, М., 1962; Чижиков Д. М., Кадмий, 2 изд., М., 1967; Щербов Д. П., Матвеец М. А., Аналитическая химия кадмия, М., 1973; Арсенид и фосфид кадмия, Киш., 1976; Федоров П. И., Химия и технология малых металлов. Висмут и кадмий, М., 1986.
П. И. Федоров
Значения в других словарях
- кадмий — -я, м. 1. Химический элемент, серебристо-белый мягкий металл, содержащийся в цинковых рудах. 2. Искусственная желтая краска разных оттенков. [лат. cadmium из греч.] Малый академический словарь
- кадмий — Ка́дм/ий/. Морфемно-орфографический словарь
- Кадмий — (Cadmium) Cd, химический элемент II группы периодической системы Менделеева; атомный номер 48, атомная масса 112,40; белый, блестящий, тяжёлый, мягкий, тягучий металл. Большая советская энциклопедия
- кадмий — орф. кадмий, -я Орфографический словарь Лопатина
- КАДМИЙ — КАДМИЙ (символ Cd), серебристо-белый металл из второй группы периодической таблицы. Впервые выделен в 1817 г. Содержится в гриноките (в форме сульфида), но в основном его получают в качестве побочного продукта при извлечении цинка и свинца. Научно-технический словарь
- Кадмий — Cd (от греч. kadmeia — цинковая руда * a. cadmium; н. Kadmium; ф. cadmium; и. cadmio), — хим. элемент II группы периодич. системы Mенделеева, ат.н. 48, ат. м. 112,41. Горная энциклопедия
- Кадмий — (Cadmium, Cd) химический элемент II группы периодической системы Д.И. Менделеева; атомный номер 48, атомная масса 112,40; соединения кадмия оказывают токсическое действие на организм человека. Медицинская энциклопедия
- кадмий — КАДМИЙ -я; м. [лат. cadmium из греч. kadmeia — цинковая руда] 1. Химический элемент (Cd), серебристо-белый мягкий, тягучий металл, содержащийся в цинковых рудах (входит в состав многих легкоплавких сплавов, используется в атомной промышленности). Толковый словарь Кузнецова
- кадмий — Кадмия, мн. нет, м. [греч. kadmia – цинк]. Блестящий белый металл, содержащийся в цинке, химический элемент 2-й группы периодической системы (хим.). || Название красок (желтых), приготовляемых из этого металла (живоп.). Большой словарь иностранных слов
- кадмий — К’АДМИЙ, кадмия, мн. нет, ·муж. (·греч. kadmia — цинк). Блестящий белый металл, содержащийся в цинке, — химический элемент 2-й группы периодической системы (·хим. ). | Название красок (желтых), приготовляемых из этого металла (живоп.). Толковый словарь Ушакова
- кадмий — КАДМИЙ м. металл (одно из химических начал или не разлагаемых стихий), встречаемый в цинковой руде. Кадмиевый, к кадмию относящ. Кадмистый, содержащий в себе кадмий. Толковый словарь Даля
- кадмий — кадмий I м. Химический элемент, серебристо-белый металл, содержащийся в цинковых рудах и входящий в состав многих легкоплавких сплавов. II м. Искусственная жёлтая краска разных оттенков, применяемая в фресковой или масляной живописи, керамике и т.п. Толковый словарь Ефремовой
- КАДМИЙ — КАДМИЙ (лат. Cadmium) — Cd, химический элемент II группы периодической системы, атомный номер 48, атомная масса 112,41. Название от греческого kadmeia — цинковая руда. Большой энциклопедический словарь
- Кадмий — (хим.) — металл, химич. знак Cd, вес атома = 112. Встречается в немногих и редких минералах (напр. гриноките CdS), чаще вместе с цинком, преимущественно в цинковой обманке (см. Энциклопедический словарь Брокгауза и Ефрона
- кадмий — КАДМИЙ, я, м. 1. Химический элемент, серебристо-белый мягкий металл. 2. Жёлтая краска, получаемая на основе этого элемента или синтетически. | прил. кадмиевый, ая, ое. Толковый словарь Ожегова
