кадмия оксид
КАДМИЯ ОКСИД CdO
аморфное вещество или кристаллы с кубич. решеткой (а — 0,46918 нм, z = 4, пространственная группа Fm3m) от зеленовато-желтого до темно-коричневого и черного цвета; т. возг. 1570 °C (летуч уже выше 900 °C); плотн. 8,2 г/см3; С0р 46,3 Дж/(моль∙К); ΔH0обр −260 кДж/моль; S0298 55 Дж/(моль∙К); уравнение температурной зависимости давления пара (в гПа): lgp = 9,685 — 12310,5/T(594 — 1520 К), в парах полностью диссоциирует на элементы. Полупроводник n-типа. Легко взаимод. с кислотами, поглощает CO2 из воздуха, с расплавами щелочей образует соли — кадматы. Легко восстанавливается H2 (при 300 °C), CO (выше — 350 °C), С (выше ~ 500 °C). Получают CdO сжиганием паров металлич. Cd, прокаливанием Cd(OH)2 или CdCO3. Материал электродов, компонент катализаторов орг. синтеза, шихты для получения спец. стекол, смазочных материалов. В природе встречается как минерал монтепонит. Токсичен; ПДК 0,1 кг/м3. Описаны пероксиды Cd, в т. ч. CdO2 — кристаллы с кубич. решеткой типа пирита (а = 0,5311 нм); т. разл. ок. 200 °C. Соответствующий К.о. гидроксид Cd(OH)2 известен в трех модификациях: неустойчивой скрытокристаллической (α), содержащей избыток воды, гексагональной (β; а = 0,3495 нм, с = 0,4698 нм, z = 1, пространственная группа 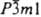 ; плотн. 4,79 г/см3) и моноклинной (γ; а = 0,567 нм, b = 1,025 нм, с = 0,341 нм, β = 91,4°, z = 4, пространственная группа Im; плотн. 4,81 г/см3). Для β-модификации ΔH0обр −561 кДж/моль; S0298 93,0 Дж/(моль∙К). Практически не раств. в воде (2,6∙10−4% по массе) и органических растворителях. Реагирует с жидким NH3, растворами цианидов щелочных металлов, горячими конц. растворами щелочей и кислотами. Выше 170 °C разлагается до CdO. Получают Cd(OH)2 действием щелочи, NH3 или (C2H5)3N на растворы солей Cd, гидролизом амминокомплексов или кадматов, анодным растворением Cd в щелочных растворах (р-форма), гидратацией CdO в щелочном растворе, гидролизом кадмийорг. соед. (γ-форма). Применяют Cd(OH)2 для получения соед. Cd, как аналитич. реагент, компонент активных масс кадмиевых электродов источников тока. Токсичен; ЛK50 45 мг/м3 (крысы, при ингаляции 0,5–1 ч), ЛД50 72 кг/кг (крысы, перорально), ПДК 0,1 мг/м3.
; плотн. 4,79 г/см3) и моноклинной (γ; а = 0,567 нм, b = 1,025 нм, с = 0,341 нм, β = 91,4°, z = 4, пространственная группа Im; плотн. 4,81 г/см3). Для β-модификации ΔH0обр −561 кДж/моль; S0298 93,0 Дж/(моль∙К). Практически не раств. в воде (2,6∙10−4% по массе) и органических растворителях. Реагирует с жидким NH3, растворами цианидов щелочных металлов, горячими конц. растворами щелочей и кислотами. Выше 170 °C разлагается до CdO. Получают Cd(OH)2 действием щелочи, NH3 или (C2H5)3N на растворы солей Cd, гидролизом амминокомплексов или кадматов, анодным растворением Cd в щелочных растворах (р-форма), гидратацией CdO в щелочном растворе, гидролизом кадмийорг. соед. (γ-форма). Применяют Cd(OH)2 для получения соед. Cd, как аналитич. реагент, компонент активных масс кадмиевых электродов источников тока. Токсичен; ЛK50 45 мг/м3 (крысы, при ингаляции 0,5–1 ч), ЛД50 72 кг/кг (крысы, перорально), ПДК 0,1 мг/м3.
П. И. Федоров
