карбиды
КАРБИДЫ (от лат. carbo — уголь)
соед. углерода с металлами, а также с бором и кремнием. По типу хим. связи К. делят на ионные (солеобразные), ковалентные и металлоподобные (ионно-ковалентно-металлические). Ионные К. (см. табл. 1) образуют металлы I и II гр. (соотв. М2C2 и МC2), РЗЭ и актиноиды (МС, М2C3, МC2), а также Al. В этих соед. атом С в зависимости от типа гибридизации (sp3, sp2 или sp) образует ионы С4−, (C=C4−, (C=C=С)4−, (C=C)2−. Ковалентные К. (см. табл. 2) образуют В и Si; атом С в этих соед. находится в состоянии sp-, sp2- и sp3-гибридизации. Металлоподобные К. образуют переходные металлы IV-VII гр., Со, Ni и Fe. В этих К. связь металл-углерод ионно-ковалентная, причем атом С отрицательно заряжен, связь металл — металл чисто металлическая, атомы С между собой не связаны.
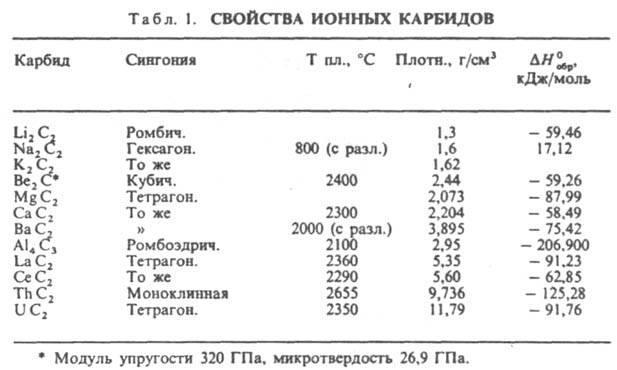
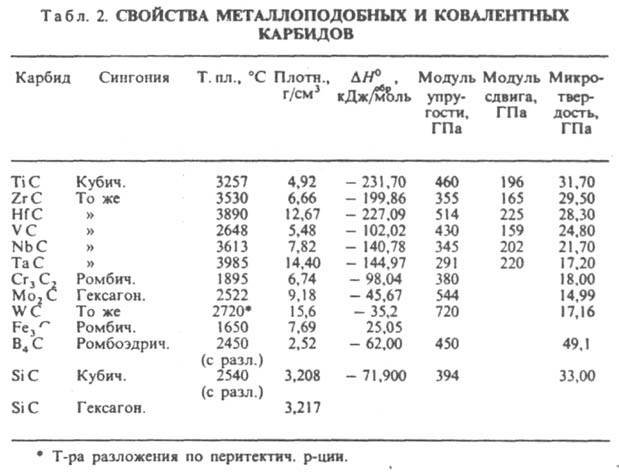
К. щелочных металлов кристаллизуются в решетках типа графита, атомы металлов размещаются между углеродными слоями, построенными из гексагон. сеток. К. щел.-зем. металлов кристаллизуются в гранецентрир. тетрагон. решетке типа CaC2, карбиды РЗЭ, монокарбиды актиноидов и переходных металлов в гранецентрир. кубической типа NaCl, сесквикарбиды актиноидов М2C3 в объемноцентрир. кубич. решетке типа Pu2C3. Ионные К. щелочных металлов разлагаются при температуре ок. 800 °C, К. щел.-зем. металлов в интервале 1800–2300 °C, ковалентные К. и металлоподобные разлагаются и плавятся при более высоких температурах. В периодич. системе в пределах группы температуры плавления К. возрастают с увеличением порядкового номера металла и обычно в 1,5–2 раза выше, чем температуры плавления соответствующих металлов. Это обусловлено высокой прочностью связи М-С. Металлоподобные К. обладают металлич. проводимостью, для них характерен положит. температурный коэф. ρ. Для сесквикарбидов величина ρ (достигает 500 мкОм.см) примерно на порядок выше, чем для дикарбидов и монокарбидов (20–50 мкОм.см). Дикарбиды РЗЭ также обладают металлич. свойствами. Карбиды В и Si, а также Be, Mg и Al — полупроводники. Мех. свойства К. зависят от прочности хим. связи, степени ее ковалентности и межатомного расстояния. Наиб. высокой твердостью обладают карбиды В, Si, Be, а также монокарбиды РЗЭ и переходных металлов; твердость последних уменьшается при переходе от К. подгруппы IVа к К. подгруппы VIa. Все К. при комнатной температуре — хрупкие вещества, их пластич. деформация возможна в условиях всестороннего сжатия при очень высоких напряжениях. Ионные К. разлагаются водой с образованием метана, ацетилена, метилацетилена или смеси углеводородов и гидроксида металла, напр.:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4;
Na2C2 + 2H2O → 2NaOH + C2H2;
Mg2C3 + 4H2O → 2Mg(OH)2 + C3H4.
Ковалентные и металлоподобные К. не разлагаются водой и большинством минеральных кислот и щелочей. Получают К. из элементов, восстановлением оксидов металлов, газофазным способом, металлотермически. Синтез из элементов осуществляют при высоких температурах в вакууме или инертной атмосфере. В зависимости от технол. параметров процесса образуются порошки с размером частиц от 0,5 мкм до 2 мм. Синтез может осуществляться в режиме горения, т. к. в результате реакции выделяется большое количество тепла, либо в плазме при 5000–10000 К в дуговых, высокочастотных и сверхчастотных плазмотронах. В результате быстрого охлаждения из парогазовой смеси элементов в плазмообразующем газе (Ar или Не) образуются ультрадисперсные порошки с размерами частиц 10–100 нм. Восстановлением оксидов металлов производят наиб. важные соед. - бора карбиды, кремния карбиды, а также вольфрама карбиды, титана карбид и др. К. переходных металлов. Газофазным способом получают К. из хим. соед., которые испаряются, разлагаются, а затем восстанавливаются и взаимод. друг с другом, напр.:
2МCl + 2CCl4 + 5H2 → 2МC + 10HCl.
Чаще всего этот синтез осуществляют в плазме, получая дисперсные порошки. По металлотермич. способу оксиды металлов восстанавливают металлами (Mg, Al или Са) в присутствии углерода, напр.:
МО + C + Mg → МC + MgO.
Особо чистые К., не содержащие кислорода и азота, синтезируют взаимод. С и металла в расплаве др. металла или сплава, напр. TiC получают в сплаве Fe Ni. Из ионных К. наиб. важен кальция карбид CaC2, из ковалентных В4С и SiC. Металлоподобные К. упрочняют чугун и сталь [Fe3C, (Fe,Cr)3C, Fe2W2C, (Fe,Cr,Mo)23C6], они являются основой твердых вольфрама сплавов (WC, TiC, WC, TiC, TaC, WC) и др. твердых сплавов (TiC, VC, Cr3C2, ТаС), используемых для обработки металлов резанием. К. применяют также как восстановители, раскислители и катализаторы, они входят в состав жаропрочных и жаростойких композиционных материалов, в т. ч. керметов.
Лит.: Стормс Э., Тугоплавкие карбиды, пер. с англ., М., 1970; Гольдшмидт X., Сплавы внедрения, пер. с англ., в. 1–2, М, 1971, Тот Л., Карбиды и нитриды переходных металлов, пер. с англ., М, 1974. Самсонов Г. В., Упадхая Г. Ш., Нешпор В. С., Физическое материаловедение карбидов, К., 1974, Высокотемпературные карбиды, под ред. Г. В. Самсонова, К, 1975, Карбиды и сплавы на их основе, под ред. Г. В. Самсонова, К, 1976, Свойства, получение и применение тугоплавких соединений, Справочник, под ред. Т. Я. Косолаповой. М, 1986.
П. С. Кислый
Значения в других словарях
- Карбиды — Соединения углерода с электроположительными элементами, главным образом с металлами и некоторыми неметаллами По типу химической связи К. могут быть подразделены на три основные группы: ионные (или солеобразные), ковалентные и металлоподобные. Некоторые... Большая советская энциклопедия
- КАРБИДЫ — КАРБИДЫ, неорганические соединения углерода с металлами или другими электроположительными элементами. БОР и КРЕМНИЙ образуют чрезвычайно твердые карбиды, которые используют как абразив. Научно-технический словарь
- КАРБИДЫ — КАРБИДЫ — химические соединения углерода с металлами и некоторыми неметаллами, напр. карбид кальция, карборунд, цементит. Карбиды вольфрама, титана, тантала, ниобия и др. Большой энциклопедический словарь
- Карбиды — См. Углерод, Углеродистый кальций, Хром, Уран, Церий, Цирконий, Торий, Чугун, Микроструктура стали. Энциклопедический словарь Брокгауза и Ефрона
