карбонаты неорганические
КАРБОНАТЫ НЕОРГАНИЧЕСКИЕ (от лат. carbo, род. падеж carbonis — уголь)
соли угольной кислоты. Существуют средние карбонаты (К.) с анионом CO32− и кислые, или гидрокарбонаты (устар. бикарбонаты), с анионом HCO3−. К. — кристаллич. вещества. Большинство средних солей металлов в степени окисления +2 кристаллизуется в гексагон. решетке типа кальцита или ромбич. типа арагонита. Из средних К. в воде раств. только соли щелочных металлов, аммония и Tl(I). В результате значит. гидролиза их растворы имеют щелочную реакцию. Наиб. трудно раств. К. металлов в степени окисления +2 (см. табл.). Напротив, все гидрокарбонаты хорошо раств. в воде. При обменных реакциях в водных растворах между солями металлов и Na2CO3 осадки средних К. образуются в тех случаях, когда их растворимость значительно меньше, чем соответствующих гидроксидов. Это имеет место для Ca, Sr и их аналогов, лантаноидов, Ag(I), Mn(II), Pb(II) и Cd(II).
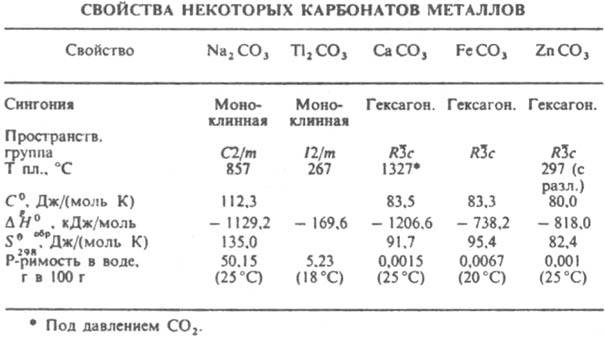
Остальные катионы при взаимодействии с растворенными К. в результате гидролиза могут давать не средние, а основные К. или даже гидроксиды. Средние К., содержащие многозарядные катионы, иногда удается осадить из водных растворов в присутствии большого избытка CO2. Хим. свойства К. обусловлены их принадлежностью к классу неорг. солей слабых кислот. Характерные особенности К. связаны с их плохой растворимостью, а также термич. нестойкостью как самих К., так и H2CO3. Эти свойства используются при анализе К., основанном либо на их разложении сильными кислотами и количеств. поглощении выделяющегося при этом CO2 раствором щелочи, либо на осаждении иона CO32− из раствора в виде BaCO3. При действии избытка CO2 на осадок среднего К. в растворе образуется гидрокарбонат, напр.: CaCO3 + H2O + CO2 → Са(НCO3)2. Присутствие гидрокарбонатов в прир. воде обусловливает ее временную жесткость (см. жесткость воды). Гидрокарбонаты при легком нагр. уже при низких температурах вновь превращаются в средние К., которые при нагр. разлагаются до оксида и CO2. Чем активнее металл, тем выше температура разложения его К. Так, Na2CO3 плавится без разложения при 857 °C, а для карбонатов Ca, Mg и Al равновесные давления разложения достигают 0,1 МПа при температурах соотв. 820, 350 и 100 °C. К. весьма широко распространены в природе, что обусловлено участием CO2 и H2O в процессах минералообразования. К. играют большую роль в глобальных равновесиях между газообразным CO2 в атмосфере, растворенным CO2 и ионами HCO3− и CO32− в гидросфере и твердыми солями в литосфере. Важнейшие минералы — кальцит CaCO3, магнезит MgCO3, сидерит FeCO3, смитсонит ZnCO3 и некоторые др. (см. карбонаты природные). Известняк состоит в осн. из кальцита или кальцитовых скелетных остатков организмов, редко из арагонита. Известны также прир. гидратированные К. щелочных металлов и Mg (напр., MgCO3.3H2O, Na2CO3.10H2O), двойные К. [напр., доломит CaMg(CO3)2, трона Na2CO3.NaHCO3.2H2O] и основные [малахит CuCO3.Cu(OH)2, гидроцеруссит 2PbCO3.Pb(OH)2]. Наиб. важны калия карбонат, кальция карбонат и натрия карбонат. Мн. прир. К. весьма ценные металлич. руды (напр., карбонаты Zn, Fe, Mn, Pb, Cu). Гидрокарбонаты выполняют важную физиол. роль, являясь буферными веществами, регулирующими постоянство pH крови.
П. М. Чукуров
