карбонилы металлов
КАРБОНИЛЫ МЕТАЛЛОВ
соед. металлов с оксидом углерода. Известны для большинства переходных металлов. Наиб. изучены К.м. VI-VIII групп. В молекулах К.м. группы CO связаны с атомом металла через атомы С: электронная пара от атома С передается атому металла, образуя σ-связь, a d-электроны металла переходят на вакантные разрыхляющие π*-орбитали CO (π-связь). За редким исключением металл координирует такое число групп CO, чтобы его электронная оболочка достраивалась до оболочки стоящего за ним благородного газа. При этом принимают, что CO является донором двух электронов, а металл находится в нулевой степени окисления (в нейтральных К.м.). К. м. могут быть одноядерными (содержат 1 атом металла), напр. Ni(CO)4, Fe(CO)5, и многоядерньгми, напр. Re2(CO)10, MnRe(CO)10, Rh6(CO)16. В многоядерных К.м. (карбонильных кластерах) атомы металла (или металлов) связаны между собой непосредственно и во мн. случаях также с помощью мостиковых групп СО. Существуют ионные карбонилы карбонилметаллат-анионы, напр. [Mn(CO)5]−, [Fe3(CO)11], и карбонилметалл-катионы, напр. [Mn(CO)6]+. Различают гомолигандные К.м., содержащие в качестве лигандов только группы CO, и гетеролигандные (напр., карбонилгидриды, карбонилгалогениды), которые фактически являются продуктами замещения части групп CO в гомолигандных К. м. на др. лиганды. Большинство К.м. — легколетучие, легкоплавкие кристаллич. вещества; М(CO)5, где М — Fe, Ru, Os, и Ni(CO)4 жидкости. К. м., за исключением V(CO)6, диамагнитны. Молекула Ni(CO)4 имеет конфигурацию тетраэдра, М(CO)6, где М = Cr, Mo, W, V, — октаэдра, Fe(CO)5 тригональной бипирамиды. К. м. раств. в органических растворителях, однако растворимость отдельных многоядерных соед., напр. Ru3(CO)12 и Rh6(CO)16, крайне мала. При нагр. К. м. разлагаются на CO и металл. Некоторые К.м. обладают высокой токсичностью; особенно ядовиты Ni(CO)4 и Fe(CO)5. В ИК спектрах имеются характеристич. полосы 1800–2200 см −1 (валентные колебания групп CO). Группы CO в К. м. могут замещаться на др. лиганды (L) фосфины, фосфиты, амины, изонитрилы, непредельные орг. соед. и др., напр.:
Cr(CO)6 + L → [Cr(L)(CO)5] + CO;
Fe(CO)5 + CH2=CHCH=CH2 → [Fe(η-C4H6)(CO)3] + 2СО.
Реакции замещения используют для синтеза гетеролигандных К.м., включая металлоорг соед. разл. типов. К. м. окисляются кислотами, галогенами, O2, H2O2, хлораминами и др. Так, М2(CO)10, где М — Mn, Re, при нагр. с HNO3 или H2SO4 дают соответствующие соли. При взаимодействии с галогенами образуются карбонилгалогениды или галогениды металлов, напр.:
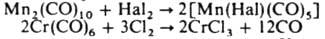
Многие К.м. легко окисляются на воздухе. К.м. реагируют с щелочными металлами или с их гидроксидами, давая карбонилметаллат-анионы, напр..
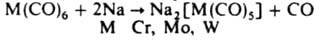
При действии оснований К.м. диспропорционируют: 3Mn2(CO)10 + 12L → 2[Mn(L)6][Mn(CO)5]2 L — пиридин, пиперидин и др. амины. К.м. получают взаимод. CO с металлами (Fe, Ni, Co) либо с их солями или др. соед. в присутствии восстановителей (H2, Zn, Mg, Na, алюминийорг. соед., реактивы Гриньяра, комплексные гидриды металлов и др.). Карбонилы некоторых металлов (напр., Cu, Ag, Pd и Pt) синтезируют путем соконденсации паров металла с твердым СО. К.м. используют для получения металлич. порошков, покрытий, монолитных форм; как катализаторы и инициаторы хим. процессов [гидрирование, гидроформилирование, гидрокарбоксилирование, полимеризация, изомеризация и диспропорционирование олефинов (метатезис), конверсия водяного газа и др.]; для получения металлоорг. соединений. Карбонилы Mn антидетонатор моторных топлив.
• см. также железа карбонилы, кобальта карбонилы, марганца карбонилы, никеля тетракарбонил, хрома карбонилы. О карбонилах W и Mo см. соотв. вольфрам и молибден.
Лит.: Соколик Р. А., в кн.: Методы элементоорганической химии. Типы металлоорганических соединений переходных металлов, под общ. ред. А. Н. Несмеянова и К. А. Кочешкова, кн. 1, М., 1975. с. 19–161. Сыркин В. Г., Карбонилы металлов, М., 1983.
Л. В. Рыбин
Значения в других словарях
- Карбонилы металлов — Соединения металлов с окисью углерода общей формулы Mem(CO)n. Впервые (в 1890) был открыт карбонил никеля Ni(CO)4. С тех пор получены карбонилы многих металлов и некоторых неметаллов. В зависимости от числа атомов металла в молекуле К. Большая советская энциклопедия
- КАРБОНИЛЫ МЕТАЛЛОВ — КАРБОНИЛЫ МЕТАЛЛОВ — химические соединения металлов с оксидом углерода СО. Напр., карбонилы никеля Ni(CO)4 и железа Fe(CO)5 — жидкости с tкип 42,3 и 103 °С, кобальта Со2(СО)8 — твердое вещество с tпл 51 °С. Большой энциклопедический словарь
