катализ
КАТАЛИЗ (от греч. katalysis — разрушение)
изменение скорости хим. реакции при воздействии веществ (катализаторов), которые участвуют в реакции, но не входят в состав продуктов. Катализатор не находится в стехиометрич. отношениях с продуктами и регенерируется после каждого цикла превращ. реагентов в продукты. Различают положительный и отрицательный К., в зависимости от того, ускоряет катализатор реакцию или замедляет ее. Как правило, термин "К." относят к ускорению реакции; вещества, замедляющие реакцию, наз. ингибиторами. Каталитич. действие на реакцию могут оказывать образующиеся в ходе реакции промежут. вещества или продукты (см. автокатализ). Для К. характерно, что небольшие количества катализатора ускоряют превращ. больших количеств реагирующих веществ. Так, 1 мас. ч. Pt-катализатора вызывает превращ. 104 мас. ч. SO3 в SO2 или 106 мас. ч. NH3 в NO. Ускоряющее действие растворителя на реакцию в растворах обычно не относят к К. на том основании, что количество растворителя, как правило, значительно превышает количество растворенных реагирующих веществ. Известны, однако, случаи ускорения реакций в присутствии очень малых добавок растворителя, напр. воды. Неизменность хим. состава и структуры катализатора по окончании процесса вряд ли может служить обязательным признаком К. Известно, что хим. состав выгруженного из реактора катализатора существенно иной, чем у загруженного; на состав и структуру катализатора влияет состав реакц. смеси.
Неизменность хим. состава и структуры катализатора имеет смысл рассматривать по отношению к той из элементарных стадий сложной каталитич. реакции, в которой непосредственно участвует катализатор, однако для этого необходимо надежно установить механизм реакции, что не всегда возможно.
Термин "К." введен И. Берцелиусом в 1835.
При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе в молекулярно-дисперсном состоянии. При гетерогенном катализе катализатор образует самостоят. фазу, отделенную границей раздела от фазы, в которой находятся реагирующие вещества. Выделяют также гетерогенно-гомогенный К., при котором реакция начинается на поверхности твердого катализатора, а затем продолжается в объеме. Межфазным катализом принято называть К. на границе двух несмешивающихся жидкостей; при этом роль катализатора состоит в переносе реагентов между фазами. Промежут. положение между гомогенным и гетерогенным К. занимает микрогетерогенный К. коллоидными частицами в жидкой фазе. Ускорение реакций в присутствии мицелл ПАВ наз. мицеллярным катализом. Исключительную роль в процессах в живых организмах играет ферментативный катализ, обусловленный действием ферментов.
Важным компонентом пром. катализаторов являются промоторы — вещества, добавление которых к катализатору в малых количествах (проценты или доли процента) увеличивает его активность, селективность или устойчивость. Если промотор добавляется к катализатору в больших количествах или сам по себе каталитически активен, катализатор наз. смешанным. Вещества, воздействие которых на катализатор приводит к снижению его активности или полному прекращению каталитич. действия, наз. ядами каталитическими. Встречаются случаи, когда одна и та же добавка к катализатору при одних концентрациях и температурах является промотором, при других — ядом. В гетерог. К. широко применяют носители — вещества, сами по себе каталитически неактивные или малоактивные. Нанесение на них катализатора значительно повышает его активность, гл. обр. вследствие увеличения поверхности катализатора или предохранения его частиц от спекания (см. нанесенные катализаторы).
Общие закономерности катализа. Все каталитич. реакции — самопроизвольные процессы, т. е. протекают в направлении убыли энергии Гиббса системы. Катализатор не смещает положения равновесия хим. реакции, если не считать его влияния на коэф. активности реагирующих веществ в растворах (или коэф. летучести, в случае реакций в газовой фазе при высоких давлениях). Вблизи от равновесия один и тот же катализатор ускоряет прямую и обратную реакции в равной степени, вдали от равновесия этого может и не быть. Из неск. возможных реакций катализатор ускоряет не обязательно термодинамически наиб. выгодную, т. е. ту, для которой убыль энергии Гиббса максимальна. Например, в присутствии Bi2O3.MoO3 пропилен окисляется частично (до акролеина), в присутствии Co3O4 происходит полное окисление (до CO2 и H2O). Мерой селективности (избирательности действия) катализатора является отношение скорости vi реакции, ведущей к накоплению i-го продукта, к суммарной скорости превращ. исходных веществ во всех возможных реакциях, т. е. vi/Svi. Расчет скорости каталитич. реакции возможен на основе ряда моделей и приближений относительно ее механизма и режима протекания; для простейших случаев гомогенного и гетерогенного К. подход к расчету скорости изложен в ст. каталитических реакций кинетика.
Энергия активации Е каталитич. реакции значительно меньше, чем для той же реакции в отсутствие катализатора. Например, для некаталитич. разложения NH3 на N2 + H2 E ~ 320 кДж/моль, для того же разложения в присутствии Pt Е ~ 150 кДж/моль. Благодаря снижению E обеспечивается ускорение каталитич. реакций по сравнению с некаталитическими. Снижение E объясняется тем, что при К. реакция протекает по новому механизму, складывающемуся из элементарных реакций с меньшими энергиями активации, чем некаталитич. реакция. При т. наз. стадийном механизме К. (кривая 1 на рис.) реакция типа А → В (энергия активации E1) заменяется совокупностью стадий: 1) А + К → АК, 2) АК → В + К (энергии активации E2 и E3 соотв.), где К — катализатор, АК — устойчивое промежут. соед. реагента с катализатором. Для бимолекулярной реакции А + В → C + D стадийный механизм может осуществляться по схеме: 1) А + К → АК, 2) АК + B → K + C + D. По такой схеме протекает, напр., окисление H2 на металлич. катализаторе М: 1) М + 1/2O2 → МО, 2) МО + H2 → М + H2O. Одностадийные процессы К. (их наз. также ассоциативными или слитными) протекают по схеме: А + К → АК* : В + К. В этом случае (кривая 2 на рис.) катализатор не образует устойчивых промежут. соед. с реагентами, но входит в активир. комплекс АК*. Реакция происходит с преодолением одного потенциального барьера, разделяющего начальное и конечное состояния системы, как и некаталитич. реакция, но с пониженным значением энергии активации (E4 на рис.).
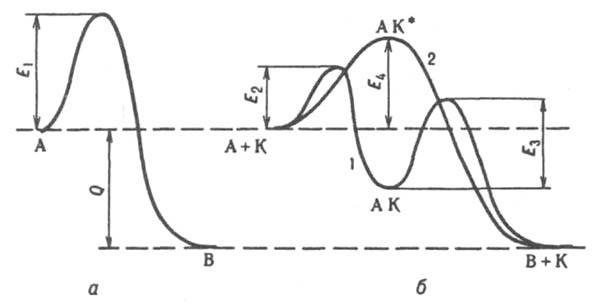
Энергетическая диаграмма реакции типа A → B; а — без катализатора, б — с катализатором К; 1 — при сталийном механизме, 2 — при ассоциативном механизме катализа: E1, E2, E4, E4 — потенциальные барьеры, разделяющие исходное и конечное состояния системы, Q — тепловой эффект реакции.
Большая скорость каталитич. реакции м. б. обусловлена не только снижением энергии активации вследствие протекания реакции по новому механизму, но и осуществлением под действием катализатора цепного механизма реакции. Например, каталитич. действие паров воды на газофазное окисление CO объясняется образованием реакц. цепей с участием активных частиц Н и ОН. В гетерогенно-гомог. К. на поверхности образуются активные частицы (напр., своб. радикалы HO2 и RO2 при окислении углеводородов RH), которые затем вылетают в газовую фазу и продолжают там цепь.
Доказано образование цепей на поверхности катализатора при полимеризации олефинов и синтезе углеводородов из CO и H2. Для мн. других гетерогенно-каталитич. реакций обнаружены особенности, характерные для цепных реакций: генерирование активных центров (чередование заполнения мест на поверхности и их освобождение), образование активных промежут. частиц в сверхравновесных концентрациях (что способствует преодолению барьера энергетически невыгодных стадий), достижение макс. скорости реакции спустя некоторое время после ее начала. Каталитич. и цепные реакции сближает также явление кинетич. сопряжения. Если превращ. катализатора при взаимодействии с реагентами сопряжены с самой каталитич. реакцией (т. е. имеют общее промежут. вещество или активир. комплекс), становится возможным образование сверхравновесных концентраций активных центров на поверхности катализатора и др. эффекты, типичные для цепных процессов.
Основные механизмы катализа. Каталитич. процессы, обусловленные переносом электрона (окисление, восстановление, гидрирование, дегидрирование, разложение нестойких кислородсодержащих соединений), относят к окислительно-восстановительному катализу. Типичными катализаторами для них являются переходные металлы и их соед.: простые оксиды (V2O5, MnO2, MoO3, Cr2O3), шпинели (Fe3O4, CuCr2O4), сульфиды (MoS2, WS2) и др.; для реакций в растворах — соли и комплексные соед. переходных металлов. Высокая каталитич. активность этих веществ объясняется тем, что атомы переходных металлов могут существовать в разл. степенях окисления, изменение которых не требует больших энергетич. затрат. В результате перенос электрона от реагента к катализатору осуществляется легче, чем в отсутствие катализатора от восстановителя к окислителю. При одноэлектронном переходе образуются своб. радикалы, далее участвующие в реакции. Например, при переходе одного электрона от активного центра молибденового катализатора к кислороду образуется ион-радикал O2, участвующий далее в каталитич. окислении (Mo5+ + O2 → Mo6+ + O2; O2 + CnHm : продукт). Существует окислительно-восстановит. К. с многоэлектронным механизмом, при котором не образуются своб. радикалы в качестве промежут. частиц. Многоэлектронные переходы между катализатором и реагирующими молекулами возможны, если в активный центр катализатора входят неск. атомов переходного металла. Например, в разложении H2O2 активны комплексные соед., содержащие 2 иона Fe3+; в восстановлении мол. азота до N2H4 — комплексные соед., содержащие 2 или более ионов V2+.
К процессам кислотно-основного катализа относятся каталитич. крекинг, гидратация, дегидратация, мн. реакции изомеризации, конденсации орг. веществ. Типичные катализаторы для этого класса процессов — вещества, способные передавать или принимать протон от реагентов или же способные к гетеролитич. взаимод. с реагентами (без разделения пары электронов). Среди этих веществ — протонные (H2SO4, CH3COOH, HF) и апротонные (BF3, AlCl3) кислоты, аморфные и кристаллич. алюмосиликаты, Al2O3, фосфаты, сульфаты. Активными центрами в них является протонный центр H+ (центр Брёнстеда ) или акцептор электронной пары, напр., атом Al (центр Льюиса). Реже применяются катализаторы основного характера (растворенные основания, твердые CaO, MgO и др.).
В случае т. наз. полифункциональных катализаторов отдельные этапы сложных каталитич. процессов окислительно-восстановительные и кислотно-основные — протекают на разных составных частях многокомпонентной многофазной системы. Например, при неполном окислении непредельных альдегидов в непредельные кислоты в присутствии оксидов Mo и V в элементарном акте происходят окислительно-восстановит. превращения катализатора:
V2O5 + CH2=CHCHO → CH2=CHCOOH + V2O4;
2MoO3 + CH2=CHCHO → CH2=CHCOOH + Mo2O5;
V2O4 + 1/2 O2 → V2O5, Mo2O5 + V2 O2 → 2MoO3
Конечная стадия реакций — десорбция кислоты — происходит на поверхностях V2O5 и MoO3, обладающих слабокислотными свойствами. В водных растворах каталитич. активность солей или комплексных соед. переходных металлов проявляется в определенном интервале pH. Это объясняется не только устойчивостью комплексных соед. при определенном pH, но и участием ионов H+ и OH− в элементарных стадиях К.
Катализ в промышленности. Несмотря на появление новых способов активации молекул (плазмохимия, радиац. химия, лазерная химия и др.), К. остается основой хим. производств. Относит. доля каталитич. процессов составляет 80–90% и продолжает возрастать; в общем объеме мирового пром. производства каталитич. процессы дают ок. 18% стоимости всей продукции. В неорганическом синтезе важнейшими каталитич. процессами являются производство H2SO4, синтез NH3 из N2 и H2, производство HNO3. В старейшем газофазном (нитрозном) способе производства H2SO4 окисление SO2 в SO3 осуществлялось в присутствии оксидов азота. В кон. 19 в. возник контактный процесс, при котором окисление SO2 в SO3 протекало в присутствии Pt, нанесенной на разл. носители. Впоследствии Pt была заменена V2O5 с добавкой K2O и др. оксидов. Контактным способом получают десятки млн. т H2SO4 ежегодно.
Пром. синтез NH3 из N2 и H2 был осуществлен в результате работ Ф. Габера и К. Боша в нач. 20 в. на железных катализаторах при давлениях ок. 300 атм и температуре 450–500 °C. В настоящее время используют более активные Fe-катализаторы, промотированные V2O5, CaO, Al2O3 и др. оксидами, что позволяет вести процесс при более низких давлениях и температурах. Водород для синтеза NH3 получают путем двух последоват. каталитич. процессов: конверсии CH4 или др. углеводородов (CH4 + H2O → CO + 3H2) на Ni-катализаторах и конверсии образующегося оксида углерода (CO + H2O → CO2 + H2). Для достижения высоких степеней превращения последнюю реакцию осуществляют в две стадии: высокотемпературной (315–480 °C) — на Fe-Cr-оксидных катализаторах и низкотемпературной (200–350 °C) — на Cu-Zn-оксидных катализаторах. Наиб. крупный потребитель NH3 — производство HNO3 окислением NH3 до NO на Pt и Pt-Rh сетках при 900–950 °C.
В органическом синтезе широкое применение К. началось в 1-й трети 20 в. благодаря работам П. Сабатье, В. Н. Ипатьева, Н. Д. Зелинского и др. Многочисл. реакции гидрирования C=C, C≡C, C=O, NO2-групп протекают на Ni-катализаторах, в числе которых Ni на носителях (кизельзуре, Al2O3) и скелетный Ni — высокопористый катализатор, получаемый выщелачиванием Ni-Al сплавов. Реже применяют Cu, Со, Pt, Pd. К крупным пром. процессам относится гидрогенизация жиров, превращ. бензола в циклогексан, нитробензола в анилин. В результате работ С. В. Лебедева и его учеников было создано производство синтетич. каучука. В его основе лежало получение мономера — бутадиена из этилового спирта по реакции 2C2H5OH → C4Hб + 2H2O + H2 на смешанном оксидном катализаторе, сочетающем дегидратирующую, дегидрирующую и конденсирующую функции, необходимые для всех стадий реакции. Впоследствии мономеры в производстве синтетич. каучука — бутадиен, изопрен, стирол — стали получать каталитич. дегидрированием соответствующих парафинов и олефинов на Al-Cr-оксидных катализаторах. Началось пром. применение экономически еще более выгодного процесса получения мономеров окислит. дегидрированием на разл. оксидах переходных металлов (RCH2CH3 + 1/2O2 → RCH=CH2 + H2O).
Широкое развитие в сер. 20 в. получили процессы каталитич. нефтепереработки; среди них — крекинг углеводородов нефти, для которого вначале основными катализаторами были аморфные алюмосиликаты, впоследствии цеолиты, отличающиеся более высокой активностью и большей селективностью по выходу парафиновых и ароматических углеводородов. Для получения высококачеств. бензинов, дизельных и реактивных топлив применяют каталитич. риформинг, алкилирование, гидрокрекинг и гидроочистку. Катализаторы риформинга — Al2O3, биметаллич. системы (Pt-Re на Al2O3), реже оксиды Mo или Cr на Al2O3; алкилирования — H2SO4, HF, AlCl3, BF3; гидрокрекинга (переработки высококипящих фракций нефти под давлением H2 в низкокипящие) — Al-Со-Mo- и Al-Ni-W-системы. Близкие по составу катализаторы применяют в процессах гидроочистки, в которых под давлением H2 тяжелые фракции нефти подвергаются обессериванию с выделением H2S; удаляются также азот- и кислородсодержащие соед. в результате гидрогенолиза соответствующих хим. связей. В условиях гидроочистки металлич. Ni-, Со-, Mo-, W-катализаторы превращаются в сульфиды (подробнее см. в статьях каталитический крекинг, каталитический риформинг).
Каталитич. переработка угля в моторное топливо началась в 20-30-х гг. 20 в. в двух вариантах: прямая гидрогенизация угольной пасты и синтез углеводородов по Фишеру-Тропшу на Co- и Fe-содержащих катализаторах. После 2-й мировой войны в связи с быстрым развитием нефтепереработки эти процессы утратили свое значение, однако затем интерес к каталитич. переработке угля возобновился в связи с начавшимся истощением запасов нефти. Появились новые катализаторы, были созданы опытно-пром. и отдельные пром. установки. Наиб. перспективен т. наз. Мобил-процесс, включающий газификацию угля, синтез метанола и послед. превращ. его в смесь углеводородов с большим выходом ароматических углеводородов C8-C12 на высококремнистых цеолитах с сечением пор, приближающимся к поперечному размеру соответствующих ароматич. молекул.
К наиб. крупнотоннажным процессам каталитич. окисления относятся: окисление этилена в этиленоксид на серебряных катализаторах, окисление метанола в формальдегид на серебре или молибдате Fe, окисление пропилена в акролеин и окислит. аммонолиз пропилена с получением акрилонитрила на молибдате Bi. Высокая селективность последних двух процессов достигается за счет введения в катализатор оксидных добавок; применяют шести- и даже восьмикомпонентные оксидные катализаторы. Из гомог. жидкофазных процессов в промышленности применяют окисление этилена в ацетальдегид в водном растворе, содержащем соли Cu и Pd, получение винилацетата окислением смеси C2H4 и CH3COOH в присутствии аналогичного катализатора и др. Каталитич. полимеризация получила развитие после открытия в 50-х гг. 20 в. К. Циглером и Дж. Наттой стереоспецифич. полимеризации олефинов на галогенидах, оксидах и др. соед. металлов IV-VIII групп (Ti, Zr, V, Cr, Mo и др.) с сокатализаторами — металлоорг. соед. Al и некоторых др. металлов I-III групп. В этих процессах получают кристаллич. полиолефины с регулярной структурой — полиэтилен, полипропилен, полибутадиен и др. (подробнее см. в статьях катализаторы окисления, катализаторы полимеризации, катализаторы процессов нефтепереработки).
Каталитич. синтезы на основе CO быстро развиваются в связи с возрастающим значением ненефтяного сырья. Разработан пром. процесс получения уксусной кислоты карбонилированием метанола в присутствии очень малых количеств солей Rh. Быстро возрастает применение К. для очистки отходящих пром. газов доокислением вредных орг. примесей в CO2 на катализаторах глубокого окисления: металлах, простых оксидах (MnO2, Fe2O3), шпинелях (CuCr2O4, CoCr2O4) и др. Перспективна также разработка катализаторов, селективно удаляющих вредные серосодержащие примеси (H2S, SO2) из отходящих пром. газов и прир. газа. В 70-х гг. 20 в. возникло новое направление каталитич. очистки — удаление примесей из выхлопных газов автомобилей. Катализатор в дожигателях выхлопных газов должен доокислять примеси углеводородов и CO до CO2, а также восстанавливать оксиды азота до N2. Используют в дожигателях Pt, Pd, Rh, нанесенные на носители.
Лит.: Проблемы кинетики и катализа, т. 1–19, Л.-М., 1935–85; Боресков Г. К., Катализ, ч. 1–2, Новосиб., 1971; Томас Ч., Промышленные каталитические процессы и эффективные катализаторы, пер. с англ., М.. 1973; Гейтс Б., Кетцир Дж., Шуйт Г., Химия каталитических процессов, пер. с англ., М., 1981; Крылов О. В., "Кинетика и катализ", 1985, т. 26, № 2, с. 263–74; Advances in catalysis, v. 1–35, N.Y.-L, 1948–87.
О. В. Крылов
Значения в других словарях
- катализ — КАТАЛИЗ а, м. catalyse f. <�гр. katalysis прекращение. Изменение скорости химической реакции под влиянием некоторых веществ (катализаторов). БАС-1. Заимствовано из фр. яз. в 1837 г. Впервые фиксируется в "Горном журнале" 1837... Словарь галлицизмов русского языка
- катализ — -а, м. хим. Возбуждение химической реакции или изменение ее скорости под влиянием катализатора. [От греч. κατάλυσις — роспуск] Малый академический словарь
- катализ — Ката́лиз/. Морфемно-орфографический словарь
- Катализ — (от греч. katálysis — разрушение) изменение скорости химических реакций в присутствии веществ (катализаторов (См. Катализаторы)), вступающих в промежуточное химическое взаимодействие с реагирующими веществами... Большая советская энциклопедия
- катализ — орф. катализ, -а Орфографический словарь Лопатина
- катализ — КАТАЛИЗ — явление самопроизвольного ускорения весьма медленно протекающих реакций. Теоретически к этой же категории должны быть отнесены все явления изменения скорости реакций в присутствии какого-либо постороннего вещества при условии... Ботаника. Словарь терминов
- Катализ — • Κατάλυσις τοῦ δήμου так называлось в Афинах ниспровержение существующего строя государства в пользу какой-нибудь другой формы правления. Словарь классических древностей
- КАТАЛИЗ — КАТАЛИЗ, изменение скорости протекания химической реакции посредством добавки вещества-КАТАЛИЗАТОРА, которое не участвует в реакции. Научно-технический словарь
- катализ — КАТАЛИЗ -а; м. [от греч. katalysis — роспуск, разрушение] Хим. Возбуждение химической реакции или изменение её скорости под влиянием катализатора. ◁ Каталитический, -ая, -ое. К-ая реакция. К-ая активность. Толковый словарь Кузнецова
- катализ — Катализа, м. [от греч. katalysis – роспуск] (хим.). Ускорение или замедление химической реакции под влиянием катализаторов. Большой словарь иностранных слов
- катализ — КАТ’АЛИЗ, катализа, ·муж. (от ·греч. katalysis — роспуск) (·хим. ). Ускорение или замедление химической реакции под влиянием катализаторов. Толковый словарь Ушакова
- катализ — катализ м. Ускорение химической реакции под влиянием некоторых веществ. Толковый словарь Ефремовой
- КАТАЛИЗ — КАТАЛИЗ (от греч. katalysis — разрушение) — ускорение химической реакции в присутствии веществ — катализаторов, которые взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. Большой энциклопедический словарь
