когезия
КОГЕЗИЯ (от лат. cohaesus — связанный, сцепленный)
сцепление частей одного и того же однородного тела (жидкого или твердого). Обусловлена хим. связью между составляющими тело частицами (атомами, ионами) и межмол. взаимодействием. Работой К. наз. свободную энергию разделения тела на части и удаления их на такое расстояние, когда нарушается целостность тела. Работу К. Wc определяют как работу обратимого изотермич. разрушения тела: Wc=2γ, где g — уд. поверхностная энергия (для твердых тел) или поверхностное натяжение (для жидкостей). Соотношение Wc и работы адгезии Wa, характеризующей сцепление разнородных тел (см. адгезия), служит для определения способности жидкостей смачивать твердые тела: при Wa /i> <sup>1</sup><i>/</i><sub>2</sub><i>W<sub>c</sub></i> имеет место несмачивание, при <sup>1</sup><i>/</i><sub>2</sub><i>W<sub>c</sub><W<sub>a</sub><W<sub>c</sub></i> — смачивание, при <i>W<sub>a</subWc растекание жидкости по поверхности твердого тела. Широко используется также понятие плотности энергии К. Eс, которую отождествляют с внутр. энергией испарения (или сублимации) Uисп, отнесенной к молярному объему вещества Vт:Fc=Uисп/Vm. По значениям Ес можно рассчитать параметр растворимости Гильдебранда 6: Ec=d2 (см. растворимость). Для низкомол. соед. энергию К. рассматривают как избыток потенц. энергии жидкости над потенц. энергией пара, численно равный внутр. энергии испарения Е при давлении р и температуре Т:
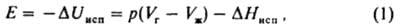
где ΔHисп энтальпия испарения, индексы "г" и "ж" означают газообразное и жидкое состояния вещества соответственно. При Vг>Vж и при условиях, когда пар ведет себя как идеальный газ, справедливо соотношение:

(R газовая постоянная). Значения Е и Ес определяют экспериментально по данным калориметрии; используют также эмпирич. соотношение Гильдебранда ΔHисп=0,02 Т2ксп+27,3Ткип — 2950. Приближенные расчеты Ес основаны на предположении об аддитивности вкладов в плотность энергии К. энергий хим. связей, соединяющих атомы (инкрементов) ΔЕi: К. низкомол. веществ связана с их агрегатным состоянием 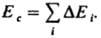 и служит для оценки свойств (термодинамич., мех. и др.). Когезионные характеристики низкомол. жидкостей и твердых тел чувствительны к их хим. природе. Так, введение в молекулы углеводородов атомов галогенов приводит к увеличению Ес от 8–25 до 10–44 кДж/моль, азота — до 14–42 кДж/моль, серы — до 12–52 кДж/моль. При введении гидроксильных, карбонильных и карбоксильных групп Ес увеличивается соотв. до 20–60, 11–30 и 22–35 кДж/моль. При этом аналогично изменяются свойства веществ (температуры кипения, плавления и сублимации, вязкость, диэлектрич. проницаемость, поверхностное натяжение и др.). Для высокомол. соед. понятие ΔHисп лишено физ. смысла и соотношение (2) не применимо. На практике обычно параметр растворимости полимера dВМС принимают равным параметру растворимости низкомол. жидкости, которая является для полимера лучшим растворителем из всех имеющихся (о растворимости полимера судят по объемному набуханию или характеристич. вязкости раствора). В случаях, если известна структурная формула повторяющегося составного (или мономерного) звена макромолекулы, можно рассчитать Ес, используя метод инкрементов. Известно ок. 10 наборов значений ΔEi позволяющих обеспечить хорошее совпадение с эксперим. данными (расхождение не превышает 5–10%). Точность расчета увеличивается, если учесть своб. объем полимера. Такой подход справедлив и для энергии когезии Еsc сегментов макромолекул. Найденные когезионные характеристики используют для корреляции с мех. прочностью, температурами плавления и стеклования, характеристиками растворимости, набухания, смачиваемости, совместимости и др. свойств полимерных материалов, важных при их переработке и практич. использовании. Эксперим. данные подтверждают связь когезионньгх характеристик полимеров с их хим. природой и строением. Так, в ряду полиолефины, полиамиды, полиакрилаты, полиарилаты, полигетероарилены Ес увеличивается от 9–25 до 40–100, 16–130, 100–160 и 90–200 кДж/моль соотв., Еsc изменяется от 15–500 до 200–700, 90–2100, 250–10000 и 550–15000 кДж/моль. Для полипептидов, отличающихся большой мол. массой и регулярным строением молекул, Ес достигает 350, а Еsc — 50000–70000 кДж/моль. Дальнейшее углубление представлений о К. предполагает рассмотрение отдельных составляющих плотности энергии К. (параметра растворимости), обусловленных разл. межмол. взаимодействиями. Обычно выделяют составляющие, связанные с диполь-дипольным (полярным) взаимод. (dр), дисперсионным взаимодействием (dd) и водородной связью (dН). Общее (суммарное) значение параметра растворимости dS определяется соотношением:
и служит для оценки свойств (термодинамич., мех. и др.). Когезионные характеристики низкомол. жидкостей и твердых тел чувствительны к их хим. природе. Так, введение в молекулы углеводородов атомов галогенов приводит к увеличению Ес от 8–25 до 10–44 кДж/моль, азота — до 14–42 кДж/моль, серы — до 12–52 кДж/моль. При введении гидроксильных, карбонильных и карбоксильных групп Ес увеличивается соотв. до 20–60, 11–30 и 22–35 кДж/моль. При этом аналогично изменяются свойства веществ (температуры кипения, плавления и сублимации, вязкость, диэлектрич. проницаемость, поверхностное натяжение и др.). Для высокомол. соед. понятие ΔHисп лишено физ. смысла и соотношение (2) не применимо. На практике обычно параметр растворимости полимера dВМС принимают равным параметру растворимости низкомол. жидкости, которая является для полимера лучшим растворителем из всех имеющихся (о растворимости полимера судят по объемному набуханию или характеристич. вязкости раствора). В случаях, если известна структурная формула повторяющегося составного (или мономерного) звена макромолекулы, можно рассчитать Ес, используя метод инкрементов. Известно ок. 10 наборов значений ΔEi позволяющих обеспечить хорошее совпадение с эксперим. данными (расхождение не превышает 5–10%). Точность расчета увеличивается, если учесть своб. объем полимера. Такой подход справедлив и для энергии когезии Еsc сегментов макромолекул. Найденные когезионные характеристики используют для корреляции с мех. прочностью, температурами плавления и стеклования, характеристиками растворимости, набухания, смачиваемости, совместимости и др. свойств полимерных материалов, важных при их переработке и практич. использовании. Эксперим. данные подтверждают связь когезионньгх характеристик полимеров с их хим. природой и строением. Так, в ряду полиолефины, полиамиды, полиакрилаты, полиарилаты, полигетероарилены Ес увеличивается от 9–25 до 40–100, 16–130, 100–160 и 90–200 кДж/моль соотв., Еsc изменяется от 15–500 до 200–700, 90–2100, 250–10000 и 550–15000 кДж/моль. Для полипептидов, отличающихся большой мол. массой и регулярным строением молекул, Ес достигает 350, а Еsc — 50000–70000 кДж/моль. Дальнейшее углубление представлений о К. предполагает рассмотрение отдельных составляющих плотности энергии К. (параметра растворимости), обусловленных разл. межмол. взаимодействиями. Обычно выделяют составляющие, связанные с диполь-дипольным (полярным) взаимод. (dр), дисперсионным взаимодействием (dd) и водородной связью (dН). Общее (суммарное) значение параметра растворимости dS определяется соотношением:
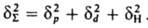
Для воды значение dS определяется в осн. наличием водородной связи и диполь-дипольным взаимод. (dН=34,2, dр=31,3,dd=12,3 МДж0,5/м1,5). Для углеводородных жидкостей с полярными галогени азотсодержащими молекулами dр соотв. в 2 и 5–10 раз больше, чем для незамещенных углеводородов. Для техн. углерода dd=21,1, dр=12,3, dН=11,2 МДж0,5/м1,5. Для полимеров отдельные составляющие dS выделить труднее; по-видимому, из-за больших размеров макромолекул нивелируются различия в межмол. взаимод. функц. групп.
Лит.: Аскадский А А., Матвеев Ю И., Химическое строение и физические свойства полимеров, М., 1983; Вакула В Л., Притыкин Л М, Физическая химия адгезии полимеров, М, 1984; Притыкин Л М и др., "Высокомолекулярные соединения", 1985. т 27А, № 1, с. 24 9; 1663 75, Роул и неон Д. Ш.. Уидом Б., Молекулярная теория капиллярности, пер с англ., М , 1986; Garden J L, "J Colloid and Interfase So.", 1977, v 59, № 3. 582 96.
Л. М. Притыкин
Значения в других словарях
- КОГЕЗИЯ — (от лат. cohaesus — связанный, сцепленный), сцепление друг с другом частей одного и того же тела, обусловленное действием сил межмолекулярного взаимодействия, водородной связи и (или) химической связи между составляющими его молекулами (атомами... Физический энциклопедический словарь
- когезия — Когезия — слипание почвенных частиц за счет их непосредственного взаимодействия или при помощи промежуточных веществ (клеев, цементов и т. д.). Толковый словарь по почвоведению
- Когезия — (от лат. cohaesus — связанный, сцепленный) сцепление молекул (атомов, ионов) физического тела под действием сил притяжения. Это силы межмолекулярного взаимодействия (См. Межмолекулярное взаимодействие), водородной связи (См. Большая советская энциклопедия
- когезия — орф. когезия, -и Орфографический словарь Лопатина
- когезия — Связность внутри предложения или между предложениями, достигаемая повторами и другими средствами. Толковый переводоведческий словарь / Л.Л. Нелюбин. — 3-е изд., перераб. — М.: Флинта: Наука, 2003 Толковый переводоведческий словарь
- когезия — 1. (лат. cohaesus связанный, сцепленный) Термин, применяемый в лингвистике текста: К. текста – связность текста. 2. Локальная связность в тексте (Н.А. Николина). Словарь лингвистических терминов Жеребило
- КОГЕЗИЯ — КОГЕЗИЯ, взаимное притяжение между атомами, ионами или молекулами какого-либо вещества. У твердых тел силы когезии велики, у жидкостей — слабее, что и обуславливает их текучесть. Жидкости образуют капли под воздействием силы поверхностного натяжения, вызываемого когезией. см. также АДГЕЗИЯ. Научно-технический словарь
- Когезия — (от лат. cohaesus — связанный, сцепленный * a. cohesion; н. Kohasion; ф. cohesion; и. cohesion) — сцепление частиц вещества (молекул, ионов, атомов), составляющих одну фазу. K. обусловлена силами межмолекулярного (межатомного) притяжения разл. природы. Горная энциклопедия
- КОГЕЗИЯ — КОГЕЗИЯ (от лат. cohaesus — связанный, сцепленный) — сцепление друг с другом частей одного и того же тела (жидкого или твердого). Обусловлена химической связью и межмолекулярным взаимодействием. Сцепление разнородных тел называется адгезией. Большой энциклопедический словарь
