лазеры химические
ЛАЗЕРЫ ХИМИЧЕСКИЕ
устройства для прямого преобразования энергии хим. реакции в энергию когерентного электромагн. излучения. Инверсия населенности уровней обусловлена неравновесным распределением энергии хим. реакции по степеням свободы молекул продукта. Для создания Л. х. используют реакции, скорость которых превышает скорость установления равновесного распределения выделяющейся энергии. Как правило, это реакции с участием химически активных атомов или радикалов. Среди них особое место занимают цепные и разветвленные цепные реакции, в которых химически активные центры (атомы и своб. радикалы) воспроизводятся (в разветвленных реакциях — размножаются) в ходе реакции. Для создания некоторого начального числа активных центров (инициирования цепной реакции) необходимо затратить энергию. Поэтому чем больше длина цепи реакции, тем большее количество хим. энергии переработается в лазерное излучение и тем меньшую роль будут играть затраты энергии на создание активных центров. При этом решающее значение имеет т. наз. хемолазерная длина цепи, определяемая как отношение скорости продолжения цепи к скорости релаксации возбужденных молекул, используемых для генерации когерентного излучения (но не к скорости гибели активных центров). Чем больше хемолазерная длина цепи, тем выше эффективность лазера по отношению к затратам энергии на инициирование реакции. Начальная концентрация активных центров м. б. создана с помощью нехим. видов энергии либо чисто хим. способом, напр. в результате термодиссоциации молекул газовой смеси, нагреваемой до высокой температуры за счет энергии протекающей в ней хим. реакции, или путем использования разветвленной цепной реакции. На нехим. инициировании основана работа мощных Л. х. импульсного действия, в которых используют заранее приготовленную смесь газов при достаточно высоком давлении (напр., атмосферном). Такая смесь содержит значит. запас энергии, но химически стабильна.
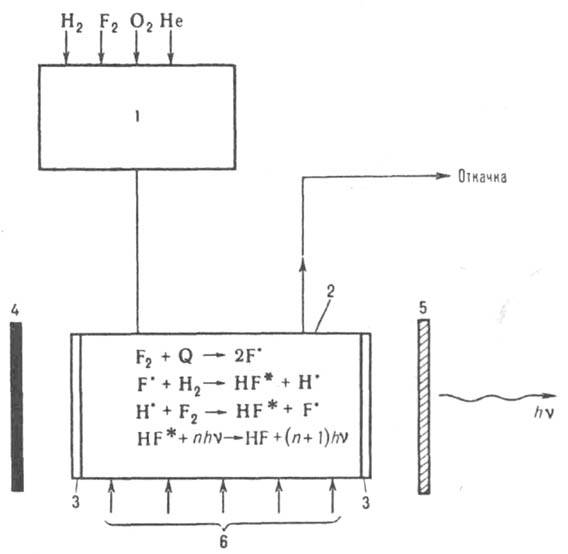
Рис. 1. Схема фтор-водородпого лазера с нехим. инициированием: 1 — смеситель; 2 — активная зона (реактор); 3 — окна для выхода излучения; 4 и 5 — зеркала (непрозрачное и частично отражающее); 6 — инициирующий агент Q (УФ излучение или пучок электронов). Указаны основные процессы в реакторе; полный их набор включает десятки процессов, в т. ч. релаксацию и гибель активных центров.
Из смесителя 1 (рис. 1) рабочая смесь поступает в реактор 2, где под действием УФ облучения или пучка электронов (инициирующий агент) инициируется быстрая молекулярно-радикальная реакция, высвобождающая запасенную в смеси энергию в виде короткого импульса когерентного излучения. При одной и той же степени инициирования чем больше хемолазерная длина цепи реакции, тем выше энергия лазерного импульса. Наиб. употребительны смеси, содержащие молекулярные фтор и водород (дейтерий), стабилизированные кислородом. Эти смеси обладают наиб. хемолазерной цепью. Генерирующими молекулами в них являются колебательно возбужденные HF* (DF*). На рис. 2 представлена схема Л. х. с чисто химическим способом инициирования, работающего на основе нецепной реакции атомарного фтора с молекулярным водородом (или дейтерием).
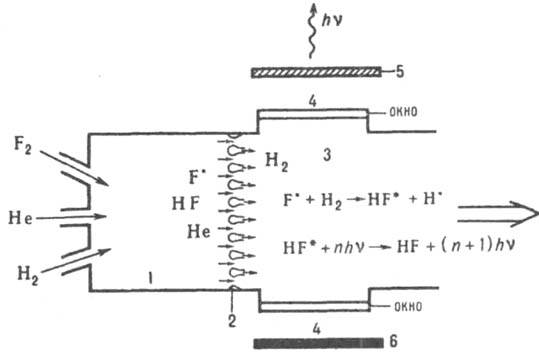
Рис. 2. Схема фтор-водородного лазера с хим. инициированием (термодиссоииацией); 1 — камера сгорания; 2 сопловый блок; 3 активная зона (реактор); 4 — окна для выхода излучения; 5 и 6 — зеркала.
Активные центры — атомы фтора — нарабатываются в камере сгорания в результате тепловой диссоциации избыточного F2, который одновременно служит окислителем горючего. В качестве горючего используют вещества, осн. требование к которым состоит в том, чтобы продукты сгорания не тушили возбужденные молекулы, образующиеся в активной зоне и генерирующие лазерное излучение. Из камеры сгорания 1 атомарный фтор выпускается через сопловую решетку 2, в которой он разгоняется до сверхзвуковых скоростей и разбивается на мелкие струи для эффективного смешения с H2, который подается в активную зону лазера. Реакция между атомарными фтором и водородом приводит к образованию колебательно возбужденных молекул HF*, которые генерируют излучение с длиной волны в диапазоне 2,7–3,2 мкм. Замена водорода дейтерием дает возможность получить когерентное излучение в диапазоне длин волн 3,8 4,2 мкм. Высокая температура в камере сгорания (~1800 К) позволяет создать высокоскоростной сверхзвуковой поток реагентов, что увеличивает мощность лазера. Гелий выполняет роль газа-разбавителя, препятствующего катастрофич. повышению температуры в лазерной зоне, которое могло бы привести к срыву генерации и тепловому запиранию сверхзвукового потока. При непрерывной подаче и откачке компонентов такие Л. х. работают в непрерывном режиме. Решающим обстоятельством при их создании является разделение в пространстве процессов наработки химически активных центров и получения возбужденных частиц, генерирующих излучение. Высокотемпературную камеру сгорания можно заменить низкотемпературной, если использовать цепную реакцию фтора с дейтерием. Атомарный фтор для инициирования цепного процесса нарабатывается при низкотемпературной реакции NO∙+F∙:F∙+NOF, начинающейся сразу при смешении их потоков. Истечение газов из камеры инициирования в лазерную зону происходит с дозвуковой скоростью, хотя возможны и сверхзвуковые варианты этого Л. х. Генерирующая молекула — CO2, которая возбуждается путем передачи колебат. энергии от DF*. Возбужденная молекула CO2 релаксирует медленнее, чем DF*, что обеспечивает большую хемолазерную длину цепи. Замена дейтерия на водород приводит к снижению генерируемой мощности, т. к. HF* передает энергию CO2 менее эффективно, чем DF*. По своим мощностным и энергетич. показателям фторводородные Л. х. импульсного и непрерывного действия пока не имеют равных. Среди др. типов Л.х. следует отметить кислород-йодный лазер, в котором генерирующая частица — атомарный иод в состоянии 3P1/2. Возбуждается он в это состояние путем передачи энергии от молекул O2 в возбужденном синглетном состоянии 1Δ, которые образуются при реакции Cl2 с водным раствором H2O2 и NaOH. Образование атомарного иода из молекулярного происходит при реакции:
2O2(1Δ)+I2:2O2(1S)+2I(3P1/2)
Основные реакции, приводящие к формированию активной среды и генерации когерентного излучения, следующие:
O2(1Δ)+I(3P3/2):O2(3S)+I(3P1/2);
I(3P1/2)+nhv:I(3P3/2)+(n +1)hv
Длина волны генерируемого когерентного излучения 1,315 мкм. Среди др. типов Л. х. перспективны лазеры на основе разветвленной цепной реакции горения CS2; генерирующая молекула-колебательно-возбужденный СО* (длина волны лазерного излучения ~5 мкм); OH-CO2 — Л.х. на основе реакции Н+O3:ОН*+O2. Колебательно-возбужденный радикал ОН* передает энергию молекуле CO2, которая генерирует лазерное излучение с длиной волны ~10 мкм. Можно ожидать создания Л. х., излучающего в видимом диапазоне длин волн. Л. х. широко применяют в научных экспериментах в хим. кинетике, лазерной химии и спектроскопии. Это обусловлено прежде всего тем, что в диапазоне длин волн, равных 3–4 мкм, нет других достаточно интенсивных источников когерентного излучения. Техн. применения Л.х. находятся в процессе разработки. Рассматриваются проекты использования мощных фтор-водородных и кислород-йодных Л.х. для управляемого термоядерного синтеза. Кислород-йодный Л.х., генерирующий излучение в ближнем ИК диапазоне, представляет интерес для обработки материалов. Спектр излучения фтор-водородных и кислород-йодных Л. х. перекрывает диапазон поглощения огромного числа разл. молекул. Возможность генерации большого набора частот в одном лазерном импульсе делает эти Л. х. перспективными для создания систем диагностики и контроля состава газовых смесей, в т. ч. дистанционных локаторов состава и состояния атмосферы — лидаров. Не исключено, что Л. х., обладая большой энергией излучения на единицу массы расходуемых реагентов, окажутся полезными при развитии технологии в космосе (напр., лазерной сварки). В иностранной литературе обсуждаются военные применения Л. х.
Лит.: Химические лазеры, под ред. Р. Гросса и Дж. Ботта, пер. с англ.. М., 1980; Химические лазеры, под ред. Н. Г. Басова, М., 1982; Басов Н. Г., Ораевский А.Н., Химические лазеры, в кн.: Наука и человечество, М., 1983, с. 259 73.
А. Н. Ораевский
