летучесть
ЛЕТУЧЕСТЬ (футитивность)
термодинамич. величина, служащая для записи зависимости химического потенциала индивидуального вещества или компонента смеси от параметров состояния (давления р, температуры Т, состава). Для индивидуального (чистого) реального газа Л. f(T, р)определяется соотношением:
m(T, р) = m0(T) + RT lnf( T,р), (1)
где m(T, р) — хим. потенциал вещества, m0(T) — его стандартный хим. потенциал, равный хим. потенциалу в некотором гипотетич. состоянии, в котором при данной температуре и давлении, равном 1 (p = 1 атм), газ обладал бы свойствами идеального газа; R — газовая постоянная. Для i-го компонента газовой смеси.
mi(T,p,N1,...,Nk_1) = mi0(T) + RT lnfi(T,p,N1,...,Nk_1), (2)
где k — число компонентов, N1,..., Nk_1 — молярные доли 1-го,..., (k-1)-го компонентов, fi — летучесть i-го компонента. Если рассматривают два состояния системы с одинаковой температурой, летучести компонента в этих состояниях fi' и fi: связаны с его хим. потенциалами mi' и mi'' соотношением:
ln (fi:/fi') = (mi''-mi')/RT. (3)
При предельном разрежении газа (p:0) Л. компонента совпадает с его парциальным давлением pi = pNi. где Ni — молярная доля, т. е. lim (fi/pi) = 1. Л. индивидуального (чистого) вещества при р:0 равна давлению. Л. идеального газа совпадает с давлением. Величину γi=fi/pi наз. коэффициентом летучести (для индивидуального газа γ = f/p). По форме (1) и (2) аналогичны выражениям для хим. потенциала чистого идеального газа и компонента смеси идеальных газов соотв.:
mид(T,p) = m0(T) + RT ln p, (4)
mi ид(T, p, Ni) = mi0(T) + RT ln pi, (5)
причем стандартные хим. потенциалы m0(T) и mi0(T) в выражениях (1) и (4), (2) и (5) совпадают. Поэтому уравнения, являющиеся следствием зависимостей (4) и (5) для идеального газа, можно применить к реальному газу, заменив в них давление р (парциальное давление pi) на Л. В частности, в случае газофазной реакции 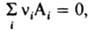 где ni — стехиометрич. коэффициенты реагирующих веществ Аi, константа хим. равновесия для идеальных газов
где ni — стехиометрич. коэффициенты реагирующих веществ Аi, константа хим. равновесия для идеальных газов 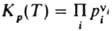 , а для реальных газов
, а для реальных газов 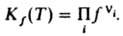 Л. вещества, являющегося компонентом конденсир. фазы (жидкой или твердой), совпадает с Л. этого вещества в равновесной паровой фазе и также подчиняется соотношениям (1)-(3). Условие равенства хим. потенциалов компонента в сосуществующих фазах эквивалентно условию равенства его Л. в этих фазах, что обычно используют при расчетах фазовых равновесий. Зависимости f(T, p)и γ(Т, р) определяются природой вещества. Величина RT lnγ представляет собой вклад в значение хим. потенциала вещества, обусловленный межмол. взаимодействиями. Характер зависимости γ(р) при Т = const для данного газа неодинаков в разл. температурных интервалах, определяемых критич. температурой Ткр. При Т а 4Ткр γ монотонно возрастает с ростом р (γ > 1, f > p), не отличаясь, однако, сильно от 1; при этом чем выше температура, тем значения γ(р) ближе к 1. В этой области температур отклонения поведения газа от идеального определяются в осн. межмол. отталкиванием. При температурах около Ткр γ с ростом р сначала уменьшается (γ < 1, f < p), затем начинает возрастать; с понижением температуры значения γ(р) уменьшаются. Для обычных мол. газов (напр., атм. воздуха) при р [ 1 атм (100 кПа) и не слишком низких температурах отличие Л. от давления незначительно. Исключение составляют ассоциированные газы, напр. пары кислот HCOOH, CH3COOH, C2H5COOH. Л. определяют экспериментально по данным о зависимости объема V системы от р при постоянной Т или рассчитывают с помощью термич. уравнения состояния. Для расчета Л. чистого вещества применяют обычно одно из след. соотношений:
Л. вещества, являющегося компонентом конденсир. фазы (жидкой или твердой), совпадает с Л. этого вещества в равновесной паровой фазе и также подчиняется соотношениям (1)-(3). Условие равенства хим. потенциалов компонента в сосуществующих фазах эквивалентно условию равенства его Л. в этих фазах, что обычно используют при расчетах фазовых равновесий. Зависимости f(T, p)и γ(Т, р) определяются природой вещества. Величина RT lnγ представляет собой вклад в значение хим. потенциала вещества, обусловленный межмол. взаимодействиями. Характер зависимости γ(р) при Т = const для данного газа неодинаков в разл. температурных интервалах, определяемых критич. температурой Ткр. При Т а 4Ткр γ монотонно возрастает с ростом р (γ > 1, f > p), не отличаясь, однако, сильно от 1; при этом чем выше температура, тем значения γ(р) ближе к 1. В этой области температур отклонения поведения газа от идеального определяются в осн. межмол. отталкиванием. При температурах около Ткр γ с ростом р сначала уменьшается (γ < 1, f < p), затем начинает возрастать; с понижением температуры значения γ(р) уменьшаются. Для обычных мол. газов (напр., атм. воздуха) при р [ 1 атм (100 кПа) и не слишком низких температурах отличие Л. от давления незначительно. Исключение составляют ассоциированные газы, напр. пары кислот HCOOH, CH3COOH, C2H5COOH. Л. определяют экспериментально по данным о зависимости объема V системы от р при постоянной Т или рассчитывают с помощью термич. уравнения состояния. Для расчета Л. чистого вещества применяют обычно одно из след. соотношений:
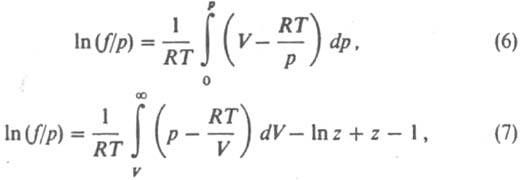
где z = pV/RT. При небольших давлениях ln (f/p)~ B2p/RT, где В2 — второй вириальный коэффициент; для грубых оценок используют соотношение f = р2/рид, где рид = RT/V. Л. жидкости определяют по давлению ее насыщ. пара рнас при заданной температуре. Для любого р
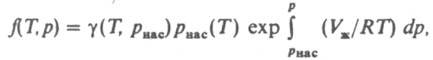
где f(T. p) — Л. жидкости, Vж — ее молярный объем, γ (Т, pнaс) — коэф. Л. вещества в паровой фазе. Аналогом выражения (6) в случае смеси газов является соотношение:
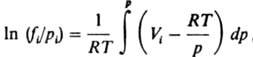
где Vi — парциальный молярный объем i-го компонента смеси. При невысоких давлениях для веществ, не сильно отличающихся по свойствам, приближенно выполняется правило Льюиса: коэф. Л. компонента газовой смеси совпадает с коэф. Л. чистого газа при давлении, равном общему давлению смеси:
γi(T, p, N1,..., Nk_1) ~ γi(T, p, Ni = 1).
Понятие Л. введено Г. Льюисом в 1901.
Лит.: Карапетьянц М. Х., Химическая термодинамика, 3 изд., М., 1975; Рид Р. К., Праусниц Дж. М., Шервуд Т., Свойства газов и жидкосгей. пер. с англ., 3 изд;, Л., 1982.
Н. А. Смирнова
Значения в других словарях
- летучесть — -и, ж. Свойство по знач. прил. летучий. Малый академический словарь
- летучесть — Лет/у́ч/есть/. Морфемно-орфографический словарь
- Летучесть — Свойство жидких и твёрдых веществ переходить в газообразное состояние; мерой Л. является концентрация насыщенного пара данного вещества при рассматриваемой температуре. Большая советская энциклопедия
- летучесть — орф. летучесть, -и Орфографический словарь Лопатина
- летучесть — ЛЕТ’УЧЕСТЬ, летучести, мн. нет, ·жен. (·книж., спец.). ·отвлеч. сущ. к летучий во 2 ·знач. Камфара известна своею летучестью. Толковый словарь Ушакова
- ЛЕТУЧЕСТЬ — ЛЕТУЧЕСТЬ (фугитивность) — термодинамическая величина, служащая для описания свойств реальных газовых смесей. Позволяет применять уравнения, выражающие зависимость химического потенциала идеального газа от температуры, давления и состава системы... Большой энциклопедический словарь
- летучесть — летучесть ж. Отвлеч. сущ. по прил. летучий Толковый словарь Ефремовой
- летучесть — См. летать Толковый словарь Даля
