лиофильность и лиофобность
ЛИОФИЛЬНОСТЬ И ЛИОФОБНОСТЬ (от греч. lyo — растворяю, philed — люблю и phobos — страх)
характеристики межмолекулярного взаимодействия вещества и среды (напр., воды, углеводорода), в которой оно находится. В случаях, когда средой служит вода, используют обычно термины "гидрофильность" и "гидрофобность" (от греч. hydor — вода), а если средой является углеводород (масло, жир) — термины "олео(или липо)фильность" и "олео(липо)фобность" (от лат. oleum и греч. lipos — масло). Если вещество и среда близки по строению молекул или молекулы вещества сильно взаимод. со средой, напр. образуют водородные связи, то говорят о лиофильности, при слабом взаимод. вещества и среды — о лиофобности. Мерой интенсивности межмол. взаимодействий может служить поверхностное натяжение γ поверхности раздела вещества со средой; степень лиофильности тем выше, чем ниже γ. Количеств. критерии перехода от лиофобности к лиофильности, характеристики и эксперим. методы определения степени Л. и л. зависят от строения изучаемой системы. Можно выделить: плоские поверхности; частицы (порошки) и пористые тела; собственно дисперсные системы, прежде всего свободнодисперсные. Понятия Л. и л. могут быть отнесены также к молекулам и их частям. Так, молекулы поверхностно-активных веществ (ПАВ) образованы гидрофильными полярными группами и олеофильными углеводородными цепями; соотношение между этими частями молекул ПАВ определяет их гидрофильно-липофильный баланс (см. также эмульсии). Л. и л. поверхности твердого тела количественно характеризуется краевым углом смачивания q (в воздушной среде); этот угол измеряется внутри жидкости (см., напр., рис., а). Поверхность лиофильна по отношению к нанесенной на нее жидкости при q < 90°. При этом поверхностное натяжение границы раздела твердого тела с жидкостью меньше, чем границы раздела твердое тело — воздух, и работы адгезии Wa и когезии Wk связаны соотношением Wa > Wk/2. Поверхность тем более лиофильна, чем ниже q; на предельно лиофильных поверхностях, когда Wa / Wk, происходит растекание жидкости. При q > 90° и Wa < Wk/2 поверхность лиофобна. Гидрофильными являются, напр., поверхности оксидов металлов, силикатных и алюмосиликатных минералов, гидрофобными — поверхности парафина, фторопластов (см. подробнее гидрофобное взаимодействие).
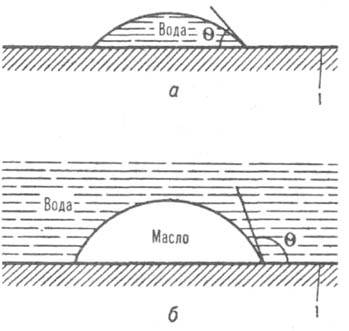
Смачивание водой гидрофильной — пов-ти (а) и избирательное смачивание олеофильной (гидрофобной) пов-ти (б); 1 — поверхность твердого тела.
Углеводороды, имеющие низкую работу когезии, растекаются по большинству поверхностей (за исключением фторопластов), поэтому олеофобность и олеофильность м. б. охарактеризованы только по углу избирательного смачивания, который измеряется при нанесении капли одной жидкости (напр., углеводорода) на поверхность раздела твердого тела с другой жидкостью (водой; рис., б); угол q отсчитывается в более полярной жидкости (воде). Л. и л. отдельных частиц можно характеризовать их способностью удерживаться поверхностью жидкости (см. флотация) или силами сцепления частиц при непосредств. контактировании в жидкости (см. структурообразование в дисперсных системах), а порошка или дисперсной пористой структуры — скоростью и равновесной высотой пропитки жидкостью. При высокой уд. поверхности порошков и пористых тел Л. и л. могут быть охарактеризованы их способностью адсорбировать пары жидкости, теплотами адсорбции и смачивания или соотношением теплот смачивания двумя жидкостями. Тепловые эффекты особенно велики для твердых тел, способных к сольватации средой и набуханию в ней; напр., для крахмала отношение теплот смачивания водой и углеводородом может достигать 20. Степень лиофильности м. б. также охарактеризована величиной "исключенного объема" жидкости (по изменению растворимости в ней разл. веществ в присутствии твердых частиц), по увеличению гидродинамич. радиуса движущихся частиц; более детальные сведения о взаимод. поверхности твердого тела со средой дают спектральные методы. Л. и л. дисперсных систем — понятия, которые первоначально использовались для описания обратимости коагуляции дисперсных систем и их чувствительности к действию малых добавок электролитов; лиофильными коллоидами наз. растворы высокомол. веществ. По совр. определению, к лиофильным коллоидным системам (ЛФЛКС) относят термодинамически равновесные микрогетерог. системы, образование которых из макроскопич. фаз сопровождается понижением термодинамич. потенциала и может идти самопроизвольно (самопроизвольное диспергирование). Лиофобные системы термодинамически неравновесны вследствие значит. избытка энергии на поверхности раздела дисперсная фаза — дисперсионная среда. Термодинамич. равновесность ЛФЛКС определяется компенсацией поверхностной энергии энтропийным фактором, связанным с участием частиц дисперсной фазы в тепловом (броуновском) движении. Такая компенсация осуществляется, если поверхностное натяжение межфазной поверхности γ12 меньше критич. величины γс = βkТ/d2, где k — постоянная Больцмана, Т — абс. температура, d — размер частиц, а коэф. β, зависящий от концентрации коллоидной системы, равен 5–10; при комнатной температуре и d ~ 10−8 м, γс составляет сотые доли мДж/м2. В ЛФЛКС реализуется равновесное распределение частиц по размерам. Узкое распределение частиц по размерам и высокое равновесное содержание вещества в коллоиднодисперсном состоянии (высокая коллоидная растворимость) характерны для дисперсий мицеллообразующих ПАВ (см. мицеллообразование); в этих дисперсиях уменьшение размеров частиц вызывает резкий рост поверхностного натяжения. Образование равновесной коллоидной системы при высокой мол. растворимости происходит в критич. системах. Лиофобные дисперсные системы образуются в результате конденсации вещества из гомог. фазы (напр., из пересыщенного раствора) или при диспергировании макроскопич. фаз путем мех. измельчения либо электрораспыления, что требует значит. затрат энергии. Возможно диспергирование и без внеш. воздействия ("квазисамопроизвольное" диспергирование). Так, если поверхностная энергия границ зерен в поликристаллич. твердом теле больше или равна удвоенной энергии границы раздела твердое тело — жидкость (условие Гиббса — Смита), жидкая фаза распространяется по границам зерен с образованием дисперсной системы, в которой частицы разделены тонкими (10−7–10−8 м) жидкими прослойками. Принципиальная термодинамич. неустойчивость лиофобных систем обусловливает протекание в них процессов, ведущих к изменению их строения и разрушению: коагуляции, коалесценции (см. эмульсии, пены), диффузионному переносу вещества от малых частиц к более крупным, седиментации. При высокой лиофильности частиц система м. б. термодинамически устойчивой к коагуляции; если при этом вещество дисперсной фазы нерастворимо в дисперсионной среде, свойства дисперсии сходны со свойствами ЛФЛКС, в частности подобные "псевдолиофильные" системы могут возникать путем пептизации гелей и скоагулированных осадков, близкой по природе к самопроизвольному диспергированию. Управление Л. и л. осуществляется хим. модифицированием поверхности, напр. "прививкой" к поверхности твердого тела лиофильных или лиофобных функц. групп, а также введением в систему ПАВ, изменяющих характер взаимод. на межфазной поверхности. В зависимости от природы ПАВ возможна как частичная или полная лиофилизация, так и лиофобизация. Особенно эффективная лиофилизация достигается при образовании на поверхностях частиц т. наз. структурно-мех. барьера — плотных слоев низко- или высокомол. ПАВ, которые имеют лиофильную наружную поверхность и способны противостоять мех. воздействию при приближении частиц друг к другу. Регулирование Л. и л. позволяет управлять свойствами поверхностей и дисперсных систем и широко используется во мн. областях техники и технологии. Понятие о Л. и л. введено в 1909 Г. Фрёйндлихом как обобщение понятия "гидрофильность и гидрофобность", предложенного Ж. Перреном в 1905; большой вклад в развитие учения о Л. и л. внесен М. Фольмером, П. А. Ребиндером, А. В. Думанским, Ф. Д. Овчаренко, Е. Д. Щукиным, А. И. Русановым и др.
Лит.: Сумм Б. Д., Горюнов Ю. В., Физико-химические основы смачивания и растекания, М., 1976; Физико-химическая механика и лиофильность дисперсных систем. Респ. межвед. сборник, К., в. 11, 1978; там же, 1981, в. 13; там же, 1985, в. 17; Щукин Е. Д., Перцов А. В., Амелина Е. А., Коллоидная химия, М., 1982.
А. В. Перцов
Значения в других словарях
- Лиофильность и лиофобность — (от греч. lýo — растворяю, — philéo — люблю и phóbos страх) характеристики способности веществ или образуемых ими тел к межмолекулярному взаимодействию с жидкостями. Интенсивное взаимодействие, т. Большая советская энциклопедия
- ЛИОФИЛЬНОСТЬ И ЛИОФОБНОСТЬ — ЛИОФИЛЬНОСТЬ И ЛИОФОБНОСТЬ (от греч. lyo — растворяю, phileo — люблю и phobos — страх) — понятия, качественно характеризующие взаимодействие поверхности твердого тела с жидкостью. Большой энциклопедический словарь
