магния галогениды
МАГНИЯ ГАЛОГЕНИДЫ MgX2
бесцветные кристаллы. Фторид MgF2. Помимо α-MgF2 (см. табл.) существуют тетрагон. форма β и α' с неустановленной структурой, которая при 857 °C переходит в β-модификацию. Плохо раств. в воде (0,013 г в 100 г при 25 °C). Встречается в природе в виде минерала селаита (α-MgF2). Фторид Mg получают взаимод. MgSO4 или MgO с фтористоводородной кислотой или MgCl2 с KF или NH4F. Компонент флюсов, стекол, керамики, эмалей, катализаторов, смесей для получения искусств. слюды и асбеста; оптич. и лазерный материал.
СВОЙСТВА ГАЛОГЕНИДОВ Mg
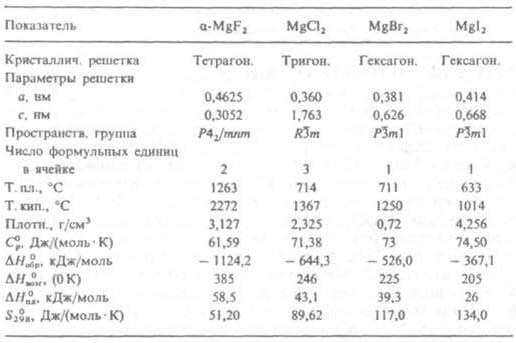
Хлорид MgCl2. Растворимость в воде (г в 100 г): 52,8 (0 °C), 54,5 (20 °C), 73,0 (100 °C); очень гигроскопичен. Т. кип. растворов, содержащих 50,7 и 85,5 г MgCl2 в 100 г воды, соотв. 142,5 и 158 °C; d425 14%-, 20%- и 32%-ных водных растворов соотв. 1,1198, 1,1757 и 1,2979. Т. пл. эвтектики (26 г MgCl2 в 100 г H2O) −33,6 °C. Выше 160 °C MgCl2 частично гидролизуется в воде. Конц. водные растворы MgCl2 растворяют MgO, из полученных растворов кристаллизуются MgCl2.mMg(OH)2.nH2O, где т = 2–9, а п = 2–8. Эти соед. входят в состав магнезиальных цементов. Хлорид образует кристаллогидраты с 1, 2, 4, 6, 8 и 12 молекулами воды. В интервале от −3,4 до 116,7 °C кристаллизуется гексагидрат — бесцветные кристаллы с моноклинной решеткой (а = 0,990 нм, b = 0,715 нм, с = 0,610 нм, β = 94°, z = 2, пространственная группа С2/m); т. пл. 117 °C; плотн. 1,560 г/см3. При 116,7–181,5 °C устойчив тетрагидрат, при 181,5–240 °C — дигидрат, а при 240–285 °C — моногидрат. Выше 285 °C из моногидрата образуется Mg(OH)Cl, который выше 500 °C разлагается на MgO и HCl. Хлорид Mg встречается в природе в виде минералов бишофита MgCl2.6H2O, карналлита KCl.MgCl2.6H2O, хлоромагнезита MgCl2, содержится в морской воде, рапе соляных озер и некоторых подземных рассолах. Производят хлорид в виде плава, по составу отвечающего гексагидрату, и безводной соли. Для производства плава используют: растворы, полученные концентрированием морских и озерных рассолов в испарит. бассейнах (содержание MgCl2 после кристаллизации осн. массы др. солей достигает 18–30%); рассолы, полученные подземным выщелачиванием отложений бишофита; рассолы, представляющие собой побочные продукты при получении KCl из карналлита, и др. Полученные любым способом "хлормагниевые щелока" упаривают в котлах до образования раствора с т. кип. 160 °C, который при охлаждении затвердевает. Безводный хлорид получают: постепенным обезвоживанием гексагидрата сначала до дигидрата при 100–200 °C в токе горячего воздуха, а затем до безводной соли при 100–200 °C в токе HCl; хлорированием MgO при 800–1000 °C в присутствии угля; как побочный продукт в производстве Ti. Безводный MgCl2 используют в производстве Mg и MgO, гексагидрат — для получения магнезиальных цементов. Водный раствор применяют как хладагент, антифриз, средство против обледенения летных полей аэродромов, железнодорожных рельсов и стрелок, против смерзания угля и руд, как антипирен для древесины, дефолиант и др. Бромид MgBr2. Растворимость в воде (г в 100 г): 101,5 (20 °C), 125,6 (100 °C). Т. пл. эвтектики (58,2 г MgBr2 в 100 г H2O) — 42,7 °C. Из водных растворов кристаллизуется в интервале от −42,7 до 0,83 °C в виде декагидрата, выше 0,83 °C — в виде гексагидрата. Раств. в метаноле (44,6% по массе при 25 °C), этаноле (32,7%), диэтиловом эфире (47,9%) и др. полярных органических растворителях и образует с ними сольваты. Получают взаимод. MgO или MgCO3 с Br2 в присутствии NH3. Иодид MgI2. Растворимость в воде (г в 100 г): 1.39,8 (20 °C), 187,5 (80 °C). Из водных растворов ниже 43 °C кристаллизуется в виде октагидрата, выше 43 °C — в виде гексагидрата. Хорошо раств. в полярных органических растворителях. Получают взаимод. MgO с HI.
Лит.: Фурман А. А., Неорганические хлориды, М., 1980. См. также лит. при ст. галургия.
В. И. Ксензенко, Д. С. Стасиневич
