магния карбонат
МАГНИЯ КАРБОНАТ MgCO3
бесцветные кристаллы с гексагон. решеткой (а = 0,4633 нм, с = 1,5016 нм, z = 6, пространственная группа 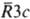 ); т. пл. 990 °C (с разл.); плотн. 3,0 г/см3; С0р 76,11 Дж/(моль∙К); ΔH0пл 59 кДж/моль, ΔH0обр −1096 кДж/моль; S0298 65,09 Дж/(моль∙К); твердость по Моосу 3,5–4,5. Начинает разлагаться до MgO при 350 °C, давление диссоциации 0,1 МПа достигается при ~650 °C. Растворимость М.к. в воде в отсутствие CO2 ~ 0,5 мг/л, под давлением CO2 она сильно возрастает. В водном растворе М.к. сильно гидролизуется, поэтому при действии растворов карбонатов металлов на растворы солей Mg в растворе образуются основные карбонаты состава xMgCO3.yMg(OH)2.zH2O, a MgCO3 м. б. получен только при действии КНCO3 в присутствии большого избытка CO2 в растворе. Безводный М.к. встречается в природе в виде минерала магнезита. В системе MgCO3-H2O кристаллизуются пента-, три- и моногидраты М.к. Пентагидрат MgCO3.5H2O (минерал ландсфордит) — бесцветные кристаллы с моноклинной решеткой (а = 1,2369 нм, b = 0,7520 нм, с = 0,7315 нм, β = 99,6°, z = 4, пространственная группа P21/m); плотн. 1,72 г/см3; ΔH0обр −2566,9 кДж/моль, ΔG0обр −2199,9 кДж/моль; растворимость 0,18 г в 100 г H2O при 20 °C. Тригидрат MgCO3.3H2O (минерал несквегонит) — бесцветные кристаллы с моноклинной решеткой (а = 1,2112 нм, b = 0,5365 нм, с = 0,7697 нм, β = 90,7°, z = 4, пространственная группа P21/т); плотн. 1,84 г/см3; ΔH0обр −1977,0 кДж/моль; растворимость 0,11 г в 100 г H2O при 20 °C. При нагр. пентагидрат переходит в тригидрат, а при 60–80 °C образуется основной карбонат состава 4MgCO3.Mg(OH)2.5H2O, который выше 200 °C начинает разлагаться до MgO. При насыщении водной суспензии М.к. CO2 происходит растворение М.к. и образуется гидрокарбонат Mg(HCO3)2, существующий только в растворе. При взаимодействии MgCO3 с карбонатами щелочных и щел.-зем. металлов образуются плохо растворимые двойные карбонаты, напр. K2Mg(CO3)2 4H2O, из которых наиб. важен MgCa(CO3)2 (минерал доломит), бесцветные кристаллы с гексагон. решеткой (а = 0,48079 нм, с = 1,16010 нм, z = 3, пространственная группа R3); плотн. 2,86 г/см3; твердость по Моосу 3,5–4. Магнезит и доломит используют для получения разл. материалов с общим техн. назв. "магнезии" (см. магния оксид), под которыми понимают не только MgO разл. плотности и дисперсности, но и основные М. к. Основные потребители магнезита — промышленность огнеупорных материалов (ок. 90% добываемого сырья) и цементная промышленность. Кроме того, магнезит и доломит — исходное сырье для получения металлич. Mg и его соед., их используют также в качестве удобрений и для снижения кислотности почв.
); т. пл. 990 °C (с разл.); плотн. 3,0 г/см3; С0р 76,11 Дж/(моль∙К); ΔH0пл 59 кДж/моль, ΔH0обр −1096 кДж/моль; S0298 65,09 Дж/(моль∙К); твердость по Моосу 3,5–4,5. Начинает разлагаться до MgO при 350 °C, давление диссоциации 0,1 МПа достигается при ~650 °C. Растворимость М.к. в воде в отсутствие CO2 ~ 0,5 мг/л, под давлением CO2 она сильно возрастает. В водном растворе М.к. сильно гидролизуется, поэтому при действии растворов карбонатов металлов на растворы солей Mg в растворе образуются основные карбонаты состава xMgCO3.yMg(OH)2.zH2O, a MgCO3 м. б. получен только при действии КНCO3 в присутствии большого избытка CO2 в растворе. Безводный М.к. встречается в природе в виде минерала магнезита. В системе MgCO3-H2O кристаллизуются пента-, три- и моногидраты М.к. Пентагидрат MgCO3.5H2O (минерал ландсфордит) — бесцветные кристаллы с моноклинной решеткой (а = 1,2369 нм, b = 0,7520 нм, с = 0,7315 нм, β = 99,6°, z = 4, пространственная группа P21/m); плотн. 1,72 г/см3; ΔH0обр −2566,9 кДж/моль, ΔG0обр −2199,9 кДж/моль; растворимость 0,18 г в 100 г H2O при 20 °C. Тригидрат MgCO3.3H2O (минерал несквегонит) — бесцветные кристаллы с моноклинной решеткой (а = 1,2112 нм, b = 0,5365 нм, с = 0,7697 нм, β = 90,7°, z = 4, пространственная группа P21/т); плотн. 1,84 г/см3; ΔH0обр −1977,0 кДж/моль; растворимость 0,11 г в 100 г H2O при 20 °C. При нагр. пентагидрат переходит в тригидрат, а при 60–80 °C образуется основной карбонат состава 4MgCO3.Mg(OH)2.5H2O, который выше 200 °C начинает разлагаться до MgO. При насыщении водной суспензии М.к. CO2 происходит растворение М.к. и образуется гидрокарбонат Mg(HCO3)2, существующий только в растворе. При взаимодействии MgCO3 с карбонатами щелочных и щел.-зем. металлов образуются плохо растворимые двойные карбонаты, напр. K2Mg(CO3)2 4H2O, из которых наиб. важен MgCa(CO3)2 (минерал доломит), бесцветные кристаллы с гексагон. решеткой (а = 0,48079 нм, с = 1,16010 нм, z = 3, пространственная группа R3); плотн. 2,86 г/см3; твердость по Моосу 3,5–4. Магнезит и доломит используют для получения разл. материалов с общим техн. назв. "магнезии" (см. магния оксид), под которыми понимают не только MgO разл. плотности и дисперсности, но и основные М. к. Основные потребители магнезита — промышленность огнеупорных материалов (ок. 90% добываемого сырья) и цементная промышленность. Кроме того, магнезит и доломит — исходное сырье для получения металлич. Mg и его соед., их используют также в качестве удобрений и для снижения кислотности почв.
Лит.: Позин М. Е., Технология минеральных солей, 4 изд., ч. 1, Л., 1974, с. 265; Карбонаты. Минералогия и химия, пер. с англ., М., 1987.
П. М. Чукуров
Значения в других словарях
- Магния карбонат — Магний углекислый, MgCO3, соль; бесцветные кристаллы, плотность 3,037 г/см3. При 500 °C заметно, а при 650 °C полностью разлагается на MgO и CO2. Растворимость М. к. в воде незначительна (22 мг/л при 25 °С) и уменьшается с повышением температуры. Большая советская энциклопедия
