марганец
МАРГАНЕЦ (от нем. Manganerz — марганцевая руда; лат. Manganum) Mn
хим. элемент VII гр. периодической системы, ат. н. 25, ат. м. 54,9380. В природе один устойчивый изотоп 55Mn. Конфигурация внеш. электронной оболочки атома 3d54s2, степени окисления от +2 до +7, наиб. устойчивы соед. Mn(II) и Mn(VII); энергии ионизации при последоват. переходе от Mn0 к Mn2+ соотв. равны 7,435 и 15,6401 эВ; электроотрицатсльность по Полингу 2,5; ионные радиусы (в скобках указаны координац. числа) Mn2+ 0,080 нм (4), 0,089 нм (5), 0,104 (7), Mn7+ 0,039 (4), 0,060 нм (6). Содержание М. в земной коре 0,1% по массе, в океанич. воде 2∙10−7%. В своб. виде в природе не встречается. Входит в состав множества минералов, преим. типа оксидов. Наиб. распространены пиролюзит β-MnO2, псиломелан mМО.nMnO2.хH2O [М = Ва, Ca, К, Mn(II)], манганит β-MnOOH, браунит 3Mn2O3.MnSiO3, родохрозит MnCO3. Главные месторождения марганцевых руд (50–75% мировых запасов, 1981) находятся в СССР. За рубежом крупнейшие месторождения известны в ЮАР (более 3 млрд. т, в пересчете на металл), Австралии (490 млн. т), Габоне (450 млн. т), Бразилии (100 млн. т), Индии (80 млн. т), Гане (10 млн. т). Общая мировая добыча марганцевых руд 20–25 млн. т/год. Большое количество М. содержат железо-марганцевые конкреции, расположенные в Тихом, Атлантическом и Индийском океанах; их ресурсы в Тихом океане оцениваются в 90–1650 млрд. т.
Свойства. Компактный М. — серебристо-белый металл. Известно 4 кубич. кристаллич. модификации М.: ниже 710 °C устойчива α-форма (а = 0,89125 нм, z = 58, пространственная группа I43m, плотн. 7,44 г/см3), при 710–1090 °C — β-форма (а = 0,6300 нм, z = 20, пространственная группа P413, плотн. 7,29 г/см3), при 1090–1137 °C — γ-форма (а = 0,38550 нм при 1100 °C, z = 4, пространственная группа Fm3m, плотн. 6,37 г/см3), выше 1137 °C — d-форма (а = 0,30750 нм при 1143 °C, z = 2, пространственная группа Im3m, плотн. 6,28 г/см3); ΔH0 полиморфных переходов (в кДж/моль) α : β 2,2, β : d 2,1, d : γ 1,9. При охлаждении до комнатной температуры γ-форма переходит в тетрагон. кристаллич. модификацию (а = 0,3774 нм, с = 0,3525 нм, плотн. 7,21 г/см3). Т. пл. 1244 °C, т. кип. ок. 2080 °C; C0p [в Дж/(моль∙К)] α-формы 26,3, β 26,5, γ 27,6; ΔH0пл 12,0 кДж/моль, ΔH0исп 227 кДж/моль; уравнения температурной зависимости давления пара lgр (Па)= 10,8828 — 13625/Т (1043 [ Т [ 1158 К) и lgp (Па) = 20,005 — 14850/T — 2,52 lgT(1517 [ T [ 2353 К); температурный коэф. линейного расширения (в К−1) в интервале 0–20 °C для α-Mn 2,23∙10−5, β 2,49∙10−5, γ 1,475∙10−5; ρ (в мкОм.см) для α-Mn ~ 140, β 91, γ 35–40; температурный коэф. ρ (в К−1) для α-Mn (2–3)∙10−4, β 1,36∙10−3, γ (5,5–6,5)∙10−3; теплопроводность 66,5 Вт/(см.К). Ниже −173 °C М. антиферромагнитен, при более высоких температурах парамагнитен; магн. восприимчивость +9,6∙10−6. Модификации α, β и d хрупкие, γ-Mn пластичен, но после деформации медленно разрушается; твердость по шкале Роквелла α-Mn 70, γ-Mn 20. М. легко окисляется на воздухе, образуя выше 800 °C окалину, состоящую из внутр. слоя MnO и внеш. слоя Mn3O4. Ниже 800 °C образуется Mn2O3, а при температурах ниже 450 °C — MnO2 (см. марганца оксиды). Поглощает H2 (до 60 см3 на 100 г М.) с образованием твердых растворов. М. взаимод. с галогенами, давая дигалогениды MnХ2 (с фтором также MnF3 и MnF4) — кристаллы; хорошо раств. в воде (кроме MnF2); образуют кристаллогидраты (см. также табл.). Для MnBr2 т. пл. 698 °C, MnI2 638 °C. Дихлорид MnCl2 получают взаимод. MnO2 с конц. соляной кислотой или Mn, MnO либо MnCO3 с газообразным HCl; применяют для получения пигментов, как катализатор в орг. синтезе, реагент для обнаружения S2O82− , IO4−, для обработки семян с целью ускорения роста растений, в физ.-хим. анализе как репер.
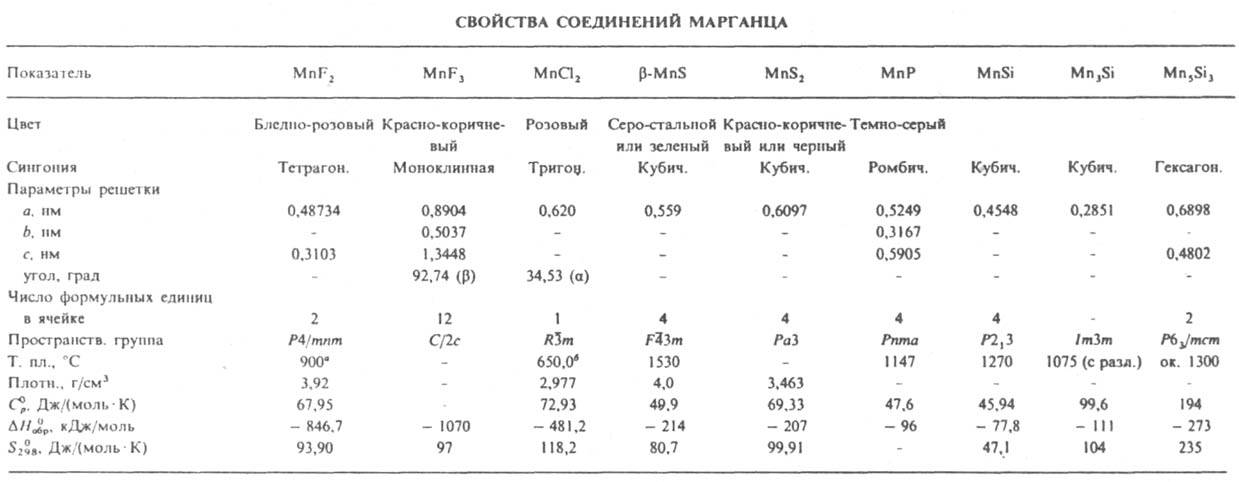
* Т. кип. ок. 1640 °C; ΔH0пл 14 кДж/моль, ΔH0исп 256 кДж/моль. * Т. кип. 1240 °C; ΔH0пл 37,6 кДж/моль, ΔH0исп 148 кДж/моль.
Трихлорид MnCl3 образуется при взаимодействии MnO2 с раствором HCl в этаноле при — 63 °C; при нагр. до 40 °C разлагается с выделением Cl2. Быстрым охлаждением паров, образующихся при взаимодействии MnF3 с F2 при температурах выше 550 °C, получают тетрафторид MnF4 — голубые кристаллы; при нагр. до 70 °C разлагается с выделением F2; ΔH0обр −1109 кДж/моль. При нагр. М. взаимод. с S, N2, P, С, Si и др. неметаллами. Известны нитриды: MnN6, Mn5N2, Mn4N, MnN, Mn6N5, Mn3N2 и MnxN с х = 9,2–25,3. Сульфид MnS существует в трех кристаллич. модификациях (β-форма — минерал алабандин); плохо раств. в воде и м. б. осажден из растворов солей Mn2+ сульфидами щелочных металлов. Фосфиды М.: MnР, MnР3, Mn2Р (т. пл. 1327 °C), Mn3Р (т. пл. 1105 °C), Mn3P2 (разлагается при 1090 °C) и Mn4Р (т. пл. 1085 °C с разл.). Карбиды М.: Mn3С [разлагается при 950 °C, C0p 93,3 Дж/(моль∙К), ΔH0обр 5,6 кДж/моль, S0298 98,7 Дж/(моль∙К)], Mn5C2 (разлагается при 1050 °C, ΔH0обр −66,1 кДж/моль), Mn15C4 (разлагается при 850 °C), Mn7C3 [разлагается при 1100 °C, ΔH0обр −98,7 кДж/моль, S0298 217 Дж/(моль∙К)], Mn23C6 (разлагается при 1025 °C, ΔH0обр −287 кДж/моль), Mn2C7. Макс. растворимость углерода в α-, β- и γ-Mn соотв. равна 1,3, 0,4 и 2,0% по массе. Силициды М.: MnSi, MnSi1,7 [т. пл. 1160 °C с разл., C0p 58,70 Дж/(моль∙К), ΔH0обр −83,7 кДж/моль, S0298 55,5 Дж/(моль∙К)], Mn3Si, Mn5Si3. М. взаимод. с водой при комнатной температуре очень медленно, при нагр. — с умеренной скоростью. Реагирует с разб. соляной и азотной кислотами и с горячей H2SO4 с образованием солей Mn2+. Из растворов солей Mn2+ (см. марганца карбонат, марганца нитрат, марганца сульфат) при pH 8,7 осаждается плохо растворимый в воде Mn(OH)2 — слабое основание. Еще более слабые основные свойства проявляет нерастворимый в воде гидроксид Mn(III). Известны неустойчивые соли ортомарганцоватистой H4MnO4 и марганцоватистой H3MnO4 кислот. Наиб. важны соли марганцоватой кислоты H2MnO4 — манганаты и марганцовой кислоты НMnO4 — перманганаты (см. манганаты).
Получение. М. получают методами металлотермии — карбо-, силико- или алюминотермич. восстановлением рудных концентратов, а также выщелачиванием руд H2SO4 с послед. электролитич. восстановлением MnSO4. Предварительно руды М. обогащают, иногда обжигают (для разложения карбонатов), восстанавливают (для перевода в соед. Mn2+) или сплавляют с кварцитом. Карботермич. восстановлением получают высокоуглеродистый ферромарганец (содержащий 6–8% С), силикотермическим — низкоуглеродистый ферромарганец ( ~ 0,1% С), алюминотермическим — чистый М. Металлич. М. с низким содержанием С и Fe получают также восстановлением концентратов силикомарганцем (содержит более 36% Si). Наиб. чистый М. с концентрацией примесей металлов менее 0,1% получают электролизом растворов MnSO4 (с концентрацией 35–40 г/л) в присутствии (NH4)2SO4 (ок. 150 г/л) при pH 8,0–8,5. Для очистки от газовых примесей жидкий М. вакуумируют или перегоняют в вакууме.
Определение. Качественно Mn3+ обнаруживают по красно-фиолетовому окрашиванию, возникающему при добавлении растворов солей Mn3+ к щелочному раствору формальдоксима, или по коричневому пятну, появляющемуся на фильтровальной бумаге (смоченной предварительно раствором 8-гидроксихинолина) после нанесения капли раствора соли Mn3+. Количественно М. определяют спектрофотометрически в виде иона MnO4 (предварительно Mn2+ и Mn3+ окисляют до MnO4 избытком КIO4 в среде HNO3-H3PO4). Из растворов Mn2+ м. б. осажден в виде MnS действием (NH4)2S; осадок имеет сначала светло-розовый цвет, который при нагр. переходит в зеленый.
Применение. М. один из основных металлов, используемых для раскисления, десульфурации и легирования сталей (более 90% производимого М. применяют в металлургии). Для удаления из стали О и S М. вводят в виде высокоуглеродистого ферромарганца (8–9 кг на 1 т стали), для легирования стали — в виде средне- и малоуглеродистого ферромарганца. М. — компонент сплавов цветных металлов, сплавов с Al и Mg. М. придает стали, Al и Mg прочность, твердость, улучшает способность к закаливанию, устойчивость к коррозии. М. применяют также для получения сплавов на его основе и для создания защитных антикоррозионных покрытий на металлах. В капиталистич. странах в производстве соед. М. ежегодно используется ок. 800 тыс. т марганцевых руд (о применении соед. М. см. соответствующие статьи), в производстве марганцевоцинковых ферритов, применяемых для изготовления трансформаторов и др. радиотехн. устройств, для получения окрашенного стекла и цветных глазурей, для фосфатирования стальных изделий — ок. 10 тыс. т/год. Производство марганцевого концентрата (тыс. т, в пересчете на металл): в Австралии 1750, Бразилии 2000, Габоне 2200, Гане 290, Индии 1400, ЮАР 3200 (1985); в СССР 9876 (1983). М. необходим для жизнедеятельности организмов. Недостаток М. у растений вызывает хлороз (недостаток хлорофилла). Некоторые почвы бедны М. и нуждаются в марганцевых удобрениях. Недостаток М. в организме человека (суточная доза составляет ок. 4 мг) также может вызывать заболевания. В то же время соед. М. токсичны, поражают центр. нервную систему, вдыхание пыли из соед. М. в течение 1–3 лет может привести к хронич. отравлениям; ПДК (в пересчете на М.) для М. как аэрозоля конденсации 0,03 мг/м , как аэрозоля дезинтеграции 0,2 мг/м3, при одновременном воздействии М. и фтора 0,15 мг/м3. М. открыл К. Шееле и выделил в чистом виде Ю. Ган в 1774.
Лит.: Позин М. Е., Технология минеральных солей, 4 изд., ч. 1, Л., 1974; Электрохимия марганца, т. 1–8, Тб., 1957–1979; Kemmitt R. D. W., Peacock R. D., The chemistry of manganese, technetium and rhenium, Oxf, 1975 (Pergamon texts in inorganic chemistry, v. 22).
Э. Г. Раков
Значения в других словарях
- марганец — -нца, м. Химический элемент, тяжелый металл серебристо-белого цвета. [От нем. Manganerz] Малый академический словарь
- Марганец — 1) город, Днепропетровская обл., Украина. Первоначально село Городище; название от городище 'место, где некогда был город, укрепленное селение'. В 1926 г. преобразован в пос. Топонимический словарь
- марганец — Ма́рганец/. Морфемно-орфографический словарь
- Марганец — I Ма́рганец (лат. Manganum) Mn, химический элемент VII группы периодической системы Менделеева; атомный номер 25, атомная масса 54,9380; тяжёлый серебристо-белый металл. В природе элемент представлен одним стабильным изотопом 55Mn. Историческая справка. Большая советская энциклопедия
- марганец — орф. марганец, -нца, тв. -нцем Орфографический словарь Лопатина
- марганец — МАРГАНЕЦ (Manganum) , Mn, хим. элемент VII гр. периодич. системы Менделеева. Металл. В земной коре содержится 0,1%. Минералы М. — пиролюзит, манганит, родонит и др. Ср. содержание М. в почвах 0,085%. Сельскохозяйственный словарь
- марганец — Заимств. в XVIII в. из нем. яз., где Marganerz — сложение Mangan «марганец» и Erz «руда». В рус. яз. в слове произошла метатеза н — р > р — н (ср. тарелка < талерка, см. тарелка). Марганец буквально — «марганцевая руда». Этимологический словарь Шанского
- Марганец — (Manganum; Mn) химический элемент VII группы периодической системы Д.И. Менделеева, ат. номер 25, ат. масса 54,9380; входит как микроэлемент в состав растительных и животных организмов; является кофактором некоторых ферментов. Медицинская энциклопедия
- МАРГАНЕЦ — МАРГАНЕЦ (символ Мn), серо-белый ПЕРЕХОДНЫЙ ЭЛЕМЕНТ, впервые был выделен в 1774 г. Его главные руды — это пиролюзит, манганит и гаусманнит. Также встречается в МАРГАНЦЕВЫХ КОНКРЕЦИЯХ. Научно-технический словарь
- Марганец — Марганець, город на Ю. Днепропетровской обл. (Украина). 50 тыс. жителей (2001). Пос. Городищенский при медном руднике возник в 1883 г., в 1926 г. переим. в Коминтерн; преобразован в город в 1938... Словарь географических названий
- Марганец — Mn (от нем. Manganerz — марганцевая руда; лат. Manganum * a. manganese; н. Mangan; ф. manganese; и. manganeso), — хим. элемент VII группы периодич. системы Менделеева, ат. н. 25, ат. м. 54,9380. Природный M. состоит из одного стабильного изотопа 55Mn. Горная энциклопедия
- марганец — МАРГАНЕЦ -нца; м. [от нем. Marganez] Химический элемент (Мn), тяжёлый металл серебристо-белого цвета. ◁ Марганцевый, -ая, -ое. М-ое месторождение. М-ая руда. М-ая сталь. Толковый словарь Кузнецова
- марганец — МАРГАНЕЦ, нца, м. Химический элемент, металл серебристо-белого цвета. | прил. марганцевый, ая, ое и марганцовый, ая, ое. Марганцевая руда. Толковый словарь Ожегова
- марганец — Марганца, мн. нет, м. [ит. manganese – марганцевая руда] (хим.). Хрупкий металл розовато-белого цвета. Большой словарь иностранных слов
- марганец — М’АРГАНЕЦ, марганца, мн. нет, ·муж. (·итал. manganese — марганцевая руда) (·хим. ). Хрупкий металл розовато-белого цвета. Толковый словарь Ушакова
- МАРГАНЕЦ — МАРГАНЕЦ — город (с 1938) на Украине, Днепропетровская обл. Железнодорожная станция. 54,7 тыс. жителей (1991). Добыча и обогащение марганцевых руд (Никопольский марганцоворудный бас.). Предприятия легкой, мебельной промышленности. Большой энциклопедический словарь
- марганец — марганец м. Химический элемент, серебристо-белый хрупкий металл, встречающийся в природе в виде соединений (оксидов, карбонатов и т.п.). Толковый словарь Ефремовой
- марганец — ма́рганец Из нем. Мanganerz, сближенного со словами на суф. -ец, или непосредственно из ит. manganese – то же; см. Преобр. I, 510; Маценауэр 250. Этимологический словарь Макса Фасмера
- марганец — МАРГАНЕЦ м. металл манган, марган; черно-бурый окисел его, употребляемый в разных производствах, особ. для добыванья кислорода. || Черный (железистый?) подзем известковой почвы. Марганцевый, к нему относящ. Толковый словарь Даля
