метакрилонитрил
МЕТАКРИЛОНИТРИЛ (нитрил метакриловой кислоты) CH2=C(CH3)CN
мол. м. 67.0; бесцветная жидкость; т. пл. −35,8 °C, т. кип. 90,3 °C; d204 0,8001; nD20 1,4007; ΔH0исп 31,8 кДж/моль, ΔH0пол 64 кДж/моль; h 0,392 мПа∙с; g 24,4 мН/м (20 °C); раств. в воде (2,59%), образует с ней азеотропную смесь (т. кип. 76,5 °C, 84% М.).
Нитрильная группа М. гидролизуется до амидной и далее до карбоксильной, гидрируется до аминометильной группы. М. присоединяет по двойной связи Hal2, HHal, спирты, тиолы, амины, а также CH-кислоты. Легко димеризуется:
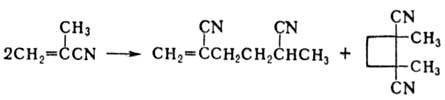
М. полимеризуется и Сополимеризуется по анионному и радикальному механизмам.
Получают М. дегидратацией ацетонциангидрина или ме-такриламида действием P2O5 и реакцией изобутилена с нитрозилхлоридом. Пром. метод: окислит. аммонолиз изобутиле-на при 300–600 °C в присутствии оксидов Со, Mn, Mo.
Сополимеры М. с акриловой и метакриловой кислотами и их эфирами используют для получения орг. стекол. Тройные сополимеры М. — стирол-бутадиен применяют в производстве электроизоляц. лаков, эмалей и пленок.
Т. всп. 12 °C. М. высокотоксичен. Характер действия такой же, как и неорг. цианидов: он проникает через кожу. ЛД50 (перорально) 15 мг/кг (мыши), 93 мт/кг (крысы). Порог запаха 0,04–0,07 мг/л (время экспозиции 1 мин); ПДК 3 мг/кг.
М. хранят и транспортируют в алюминиевой таре; стабилизаторы — металлиламин и 1-нитрозо-2-нафтол.
Лит.: Kirk-Othmer encyclopedia, 3 ed., v. 15, N.Y., 1981, p. 346.
Д. В. Иоффе
