натрия сульфат
НАТРИЯ СУЛЬФАТ Na2SO4
бесцветные кристаллы; известен в четырех полиморфных модификациях (см. табл.); показатели преломления: меньший Np = 1,469, средний Nm = 1,476, больший Ng = 1,481; кристаллизуется из водных растворов выше 32,384 °C. В интервале от −1,2 до 32,4 °C кристаллизуется декагидрат, от −3,5 до 24,25 °C — также метастабильный гептагидрат. Растворимость безводного Н.с. в воде 21,9% по массе (25 °C). Т. кип. насыщ. водного раствора (29,7% по массе Н.с.) 102,88 °C. Плохо раств. в водно-спиртовых средах; растворимость при 20 °C в этаноле 0,439% по массе, метаноле-2,40%. С K2SO4, Li2SO4 и рядом др. образует непрерывный ряд твердых растворов, с сульфатами Sc и Y-двойные соли, с SrSO4 — эвтектику.
Н.с. встречается в природе в виде минералов тенардита Na2SO4, мирабилита (глауберова соль) Na2SO4∙10H2O, входит в состав астрахонита Na2Mg(SO4)2∙4H2O, вантгоф-фита Na6Mg(SO4)4, глауберита Na2Ca(SO4)2 и др. Наиб. крупные запасы Н.с. в СССР, США, Чили, Испании и др.
Мирабилит выделяют из прир. залежей, из рапы соляных озер и обезвоживают при 100 °C. На хим. предприятиях Н.с. получают как побочный продукт при производстве соляной кислоты, соед. Cr, утилизации сульфатных щелоков в производстве искусств. волокна, на металлургич. заводах и т. д. Н. с. — компонент шихты в производстве стекла; используется при сульфатной варке целлюлозы, при крашении хл.-бум. тканей; сырье для получения силикатов Na, Na2S, H2SO4, (NH4)2SO4, соды и др.; компонент осадит. ванны в производстве вискозного волокна; глауберова соль-слабит. средство. ПДК в воздухе рабочей зоны 10,0 мг/м3.
Г и д р о с у л ь ф а т NaHSO4 — бесцветные кристаллы (см. табл.); претерпевает два полиморфных превращ. при 140 и 170 °C; показатели преломления: Np = 1,43, Nm = 1,46, Ng = 1,47; растворимость в воде 22,2% по массе (25 °C), 33,3% (100 °C), в этаноле-1,4% (25 °C). Образует моногидрат NaHSO4 ∙ H2O — бесцв. гигроскопичные кристаллы; при нагр. сначала переходит в безводную соль, а затем в Na2S2O7. Гидрат получают растворением мирабилита в 20%-ной H2SO4 с послед. упариванием на водяной бане и охлаждением, безводную соль — кристаллизацией из расплава смеси Н.с. с конц. H2SO4. Гидросульфат Na-флюс в цветной металлургии, реагент для перевода труднорастворимых оксидов в растворимые сульфаты.
СВОЙСТВА СУЛЬФАТА И ГИДРОСУЛЬФАТА НАТРИЯ
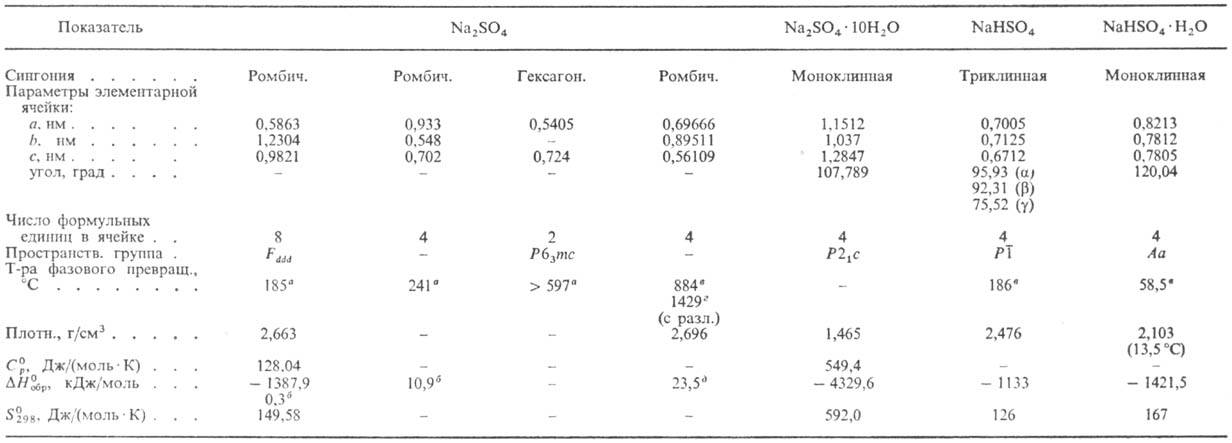
а Температура полиморфного перехода. б DH полиморфного перехода. в Температура плавления. г Температура кипения. д DH0пл .
Лит.: Шихеева Л. В., Зырянов В. В., Сульфат натрия. Свойства и производство, Л., 1978.
Н. С. Рукк
Значения в других словарях
- Натрия сульфат — Сернокислый натрий, Na2SO4, соль; бесцветные кристаллы. Встречается в природе в виде минерала Тенардита; плотность 2,698 г/см3, tпл 884 °С. Растворимость в воде (%): 16,3 (20 °С), 29,8 (100 °C). Большая советская энциклопедия
- натрия сульфат — НАТРИЯ СУЛЬФАТ (Natrii sulfas; ФХ), глауберова соль, слабительное средство. Бесцветные, прозрачные, выветривающиеся на воздухе кристаллы. Растворим в воде. Для проявления быстрого и эффективного слабит, действия применяют в 10%-ном растворе. Н. Ветеринарный энциклопедический словарь
- НАТРИЯ СУЛЬФАТ — НАТРИЯ СУЛЬФАТ — Na2SO4, бесцветные кристаллы. Растворяется в воде. Кристаллогидрат Na2SO4·10H2O — минерал мирабилит (глауберова соль). Применяют в стекольной, целлюлозной, текстильной, мыловаренной промышленности, в цветной металлургии, в медицине и ветеринарии. Большой энциклопедический словарь
