натрия супероксид
НАТРИЯ СУПЕРОКСИД (гипероксид натрия, надпероксид натрия) NaO2
желтые кристаллы; выше −50 °C устойчива фаза I кубич. сингонии (а = 0,549 нм, z = 4, пространственная группа Рт3т), в интервале от −50 до −77 °C — кубич. фаза II (а = 0,546 нм, пространственная группа Ра3), в интервале от −77 до −230 °C — ромбич. фаза III (при −100 °C а = 0,426 нм, b = 0,554 нм, с = 0,334 нм, пространственная группа Рппт), ниже −230 °C — фаза IV; плотн. 2,21 г/см3; С0р 71,88 Дж/(моль∙К); ΔH0обр −261 кДж/моль, DG0обр — 219 к Дж/моль. При непрерывном нагревании со скоростью 5 град/мин термич. распад NaO2 начинается ок. 100 °C, осн. часть кислорода выделяется при 240–300 °C, твердый продукт распада — пероксид Na2O2; дефектность кристаллов Н.с. влияет на скорость его распада.
Н.с. раств. в жидком NH3 (~0,5 г в 100 мл), при −32,5 °C из раствора выпадает аммиакат NaO2∙2NH3. Растворение NaO2 в воде сопровождается выделением O2 и образованием щелочного раствора H2O2:
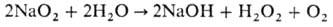
В присут. катализатора, напр. MnO2, или при нагр. реакция с водой идет по схеме:
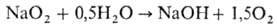
Н. с. — активный окислитель; при комнатной температуре в присутствии паров воды с SO2 образует Na2SO4, с NO2-NaNO3; при 100–180 °C поглощает CO, давая Na2CO3. В присут. паров воды при комнатной температуре CO2 полностью вытесняет активный кислород из NaO2, при этом образуется Na2CO3, в отсутствие влаги эта реакция идет лишь выше 100 °C.
Пром. способ получения Н.с. состоит в медленном нагревании Na2O2 от 200 до 450 °C в автоклаве при давлении O2 10–15 МПа. Н.с. может быть также получен окислением O2 металлич. Na в среде 1,2-диметоксиэтана в присутствии флуорена или бензофенона при обычных условиях. Н. с. — компонент систем для регенерации кислорода в замкнутых помещениях.
В. Я. Росоловский
