никеля галогениды
НИКЕЛЯ ГАЛОГЕНИДЫ
Свойства безводных дигалогенидов Ni приведены в табл. Д и ф т о р и д NiF2 образует зеленовато-желтые тетрагон. кристаллы типа рутила (TiO2); уравнение температурной зависимости давления пара: lgp( мм рт. ст.) = 20,28-14650/T+ 3,02 lg Т (298 −1220 К); устойчив на воздухе при комнатной температуре, при прокаливании окисляется до NiO; негигроскопичен; растворимость в воде почти не зависит от температуры; получают фторированием NiO, NiCl2 или др. соед. Ni. Из водных растворов NiF2 кристаллизуется в виде тетрагидрата NiF2∙4H2O — светло-зеленые кристаллы; плотн. 2,219 г/см3; при ~ 120 °C теряет одну молекулу воды, полностью обезвоживается в токе HF при 350–400 °C. Безводный NlF2 используют как катализатор фторирования, для изготовления катодов в хим. источниках тока, как компонент лазерных материалов.
Т р и ф т о р и д NiF3 образуется в виде розового осадка при электролизе расплава KHF2; сильный окислитель; разлагается водой, выделяя из нее O2.
Известны производные т е т р а ф т о р и д а NiF4, в частности K2[NiF6]: розовые или темно-красные кристаллы кубич. сингонии; разлагается во влажном воздухе; водой гидро-лизуется; получают фторированием смеси KCl с NiCl2; используют как фторирующий реагент.
Д и х л о р и д NiCl2, д и б р о м и д NiBr2 и дииодид NiI2 кристаллизуются в ромбоэдрич. решетке типа CdCl2; для NlBr2 известна также др. модификация со структурой типа CdI2; при прокаливании на воздухе окисляются до NiO; безводные соли м. б. получены действием соответствующих галогенов на Ni, обезвоживанием кристаллогидратов. Ди-хлорид — золотисто-желтые или желто-коричневые кристаллы; уравнение температурной зависимости давления пара: lgр( мм рт. ст.) = 21,88-13300/T+ 2,68 lg T(298–1220 К); гигроскопичен; раств. в воде, этаноле, гликоле. Из водных растворов в интервале от −53,4 до 28,8 °C кристаллизуется гексагидрат, при 28,8–64,3 °C-тетрагидрат, при 64,3–117,9 °C-дигидрат. Гексагидрат NiCl2∙6H2O-кристаллы от светло- до темно-зеленого цвета моноклинной сингонии (а = 1,023 нм, b = = 0,705 нм, с = 0,657 нм, b = 122,16°, пространственная группа С2т); плотн. 1,91 г/см3; в сухом воздухе выветривается, во влажном расплывается. Тетрагидрат NiCl2∙4H2O- кристаллы от желтовато-зеленого до темно-зеленого цвета тетрагон. сингонии (а = 0,662 нм, с = 1,323 нм, пространственная группа P4mmm); плотн. 1,72 г/см3. Дигидрат NiCl2∙2H2O-бледно-желтые или коричневато-желтые кристаллы моноклинной сингонии (а = 0,697 нм, b = 0,690 нм, с = 0,881 нм, b = 91,5°, пространственная группа I2/m); плотн. 2,56 г/см3; при ~ 140 °C полностью обезвоживается. Применяют NiCl2 (и его гидраты) как компонент электролитов для рафинирования Ni и для никелирования, для получения порошка Ni, как катализатор хлорирования орг. соед., безводный NiCl2-как компонент термочувствит. красок.
СВОЙСТВА БЕЗВОДНЫХ ГАЛОГЕНИДОВ НИКЕЛЯ
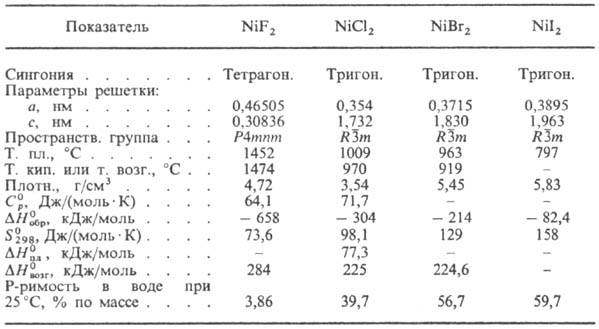
Из двойных хлоридов Ni важнейший -NH4NiCl3∙6H2O, получаемый кристаллизацией из солянокислого раствора смеси NiCl2 с NH4Cl при ~20 °C; голубовато-зеленые кристаллы; раств. в воде; при 70 °C обезвоживается (безводный NH4NiCl3-желтого или рубиново-красного цвета); выше ~170 °C разлагается; применяют как протраву при крашении, компонент электролитов для никелирования.
Безводный NiBr2 — желто-коричневого цвета, безводный NiI2-стально-серый или черный; гигроскопичны, раств. в воде, метаноле, этаноле, не раств. в диэтиловом эфире; из водных растворов кристаллизуются в виде гексагидратов. Гексагидрат NiBr2∙6H2O-зеленые кристаллы; при 28,5° теряет три молекулы воды, при ~ 200 °C полностью обезвоживается. Описаны также ди- и нонагидраты NiBr2. Гексагидрат NiI2∙6H2O-голубовато-зеленые кристаллы; при 43 °C теряет две молекулы воды, при 140 °C обезвоживается. Дибромид и дииодид Ni используют для получения катализаторов, термочувствит. красок.
П. И. Федоров
