окислительно-восстановительный потенциал
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ
равновесная разность гальвани-потенциалов (см. межфазные скачки потенциала) между электролитом (раствором, расплавом, твердым электролитом) и металлом (или др. электронным проводником), при которой с равной скоростью протекают реакции окисления и восстановления.
Простейший пример возникновения О.-в.п. представляет система, в которой устанавливается равновесие между атомами металла и соответствующими катионами раствора, напр.: Zn ⇄ Zn2+ + 2е, Cu ⇄ Cu2+ + 2е и т. п. В таких системах О.-в.п. зависит от природы металла и термодинамич. активности окисленной формы (Zn2+, Cu2+).
Если индифферентный электрод погружен в электролит, содержащий окислительно-восстановит. (редокс-) систему, то в такой системе протекает два электродных процесса, или две окислительно-восстановит. полуреакции, сопровождающиеся переходом электронов между участвующими в реакции молекулами или (и) ионами. В общем виде этот процесс м. б. изображен: Ох + ne ⇄ Red (Ox и Red — окисленная и восстановленная формы частицы или частиц, п — число электронов, участвующих в реакции). О.-в.п., возникающий в таких системах, зависит от природы редокс-реакции и от активностей (фугитивностей) обоих электроактивных соед., а также др. возможных участников процесса (напр., H+, OH− и т. д.) и не зависит от материала электрода.
На практике для определения О.-в.п. строят электрохим. цепи из некоторого стандартного электрода и электрода, на котором протекает соответствующий редокс-процесс. В водных растворах в качестве стандартного используют водородный электрод. В такой цепи эдс приравнивается к значению О.-в.п. и выражается Нернста уравнением:
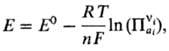
где ai;-активности участников редокс-процесса, vi — их стехио-метрич. коэффициенты, R-универсальная газовая постоянная, T — абс. температура, F- число Фарадея, причем для исходных веществ принимается vi < 0, а для продуктов реакции vi > 0. Стандартный потенциал Е0 равен О.-в.п. при активностях (или/и фугитивностях) компонентов, равных единице, и зависит от природы редокс-процесса и от температуры. В указанной цепи протекает суммарная реакция Ох + H2 ⇄ Red + 2H+ и Е0 = = — 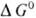 /nF, где
/nF, где 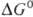 -стандартное изменение своб. энергии Гиббса для этой реакции. Таким образом, О.-в.п. можно рассматривать как меру стандартной своб. энергии редокс-процесса. В связи с этим Е0м.б. также вычислены из термодинамич. данных и констант равновесия соответствующих процессов и сами могут служить для их нахождения. Величины Е0 сведены в таблицы и с их помощью можно решать вопрос о направлении и полноте протекания тех или иных редокс-процессов.
-стандартное изменение своб. энергии Гиббса для этой реакции. Таким образом, О.-в.п. можно рассматривать как меру стандартной своб. энергии редокс-процесса. В связи с этим Е0м.б. также вычислены из термодинамич. данных и констант равновесия соответствующих процессов и сами могут служить для их нахождения. Величины Е0 сведены в таблицы и с их помощью можно решать вопрос о направлении и полноте протекания тех или иных редокс-процессов.
Вместо термина "О.-в.п." рекомендуется употреблять термины "обратимый потенциал", "потенциал окислительно-восстановит. полуреакции" или "стандартный потенциал окислительно-восстановит. полуреакции", которые более адекватно отражают физ. смысл явления образования скачка потенциала.
Лит.: Справочник химика, 2 изд., т.З, М.-Л., 1964, с. 740; Дамаскин Б. Б., Петрий О. А., Электрохимия, М., 1987; Standard potentials in aqueous solution, ed by A.J. Bard, R. Parsons, J. Jordan, N.Y., 1985.
О. А. Петрий
Значения в других словарях
- Окислительно-восстановительный потенциал — Равновесный Электродный потенциал, характеризующий данную электролитическую среду. О.-в. п. при постоянной температуре зависит только от состава среды и может быть сообщен ею погруженному в неё электронному проводнику (электроду)... Большая советская энциклопедия
- Окислительно-восстановительный потенциал — Окислительный потенциал, редокспотенциал (ОВП, Eh) — функция соотношения окисленных и восстановленных форм химических элементов в той или иной среде (почве, водном растворе, биологическом материале). Экологические термины и определения
