олефины
ОЛЕФИНЫ (алкены, этиленовые углеводороды) (от лат. oleum — масло)
ненасыщ. ациклич. углеводороды, содержащие одну двойную связь C=C; общая формула СnH2n. Атомы углерода при двойной связи имеют sp2-гибридизацию и образуют s- и p-связи. Последняя состоит из двух базисных орбиталей-связывающей и разрыхляющей, образующихся за счет р-орбиталей атомов С. Энергия связи ~615 кДж/моль. Простейший О. — этилен, валентные углы которого практически равны 120°. Для О., начиная с C4H8, наряду с изомерией углеродного скелета и разл. положения двойной связи, возможна геом. (цис-, транс-) изомерия, обусловленная большим барьером вращения вокруг двойной связи.
Названия О. образуются заменой окончания "ан" в назв. насыщ. углеводорода на "ен"; цифры перед назв. указывают положение двойной связи, напр. CH3CH=CHCH2CH3-2-пентен. Для низших членов гомологич. ряда сохранились назв. с окончанием "илен": этилен, пропилен и др.
В природе О. встречаются редко. Один из немногих прир. О. — мускалур цис-9-трикозен) — феромон, выделяемый самками домашней мухи.
При нормальных условиях этилен, пропилен и бутены — газы, О. состава C5-C18 — бесцв. жидкости, высшие О. — твердые вещества. О. практически не раств. в воде, ограниченно раств. в спиртах и хорошо — в углеводородах, их галогенопроизвод-ных, простых и сложных эфирах.
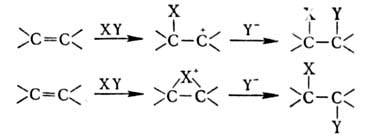
ИК спектры О. сильно отличаются от спектров алканов и имеют характеристич. полосы при 1650 см−1 (валентные колебания связи C=C) и 3100, 1420, 915–1000 см−1 (колебания винильных С—Н-связей разл. типов). В спектрах ЯМР 1Н хим. сдвиги винильных протонов 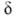 4,6–5,3 м. д. Для масс-спектров О. характерны фрагменты алкенильных ионов с т/z 41, 55, 69, 83, а также ионов с четным значением m/z 42, 56, 70.
4,6–5,3 м. д. Для масс-спектров О. характерны фрагменты алкенильных ионов с т/z 41, 55, 69, 83, а также ионов с четным значением m/z 42, 56, 70.
О. — высокореакционноспособные соединения. Наиб. характерны для них реакции электроф. присоединения по двойной связи, протекающие, как правило, по бимолекулярному механизму через стадию образования карбкатиона или мос-тикового иона:
Присоединение электрофилов подчиняется Марковникова правилу. Наличие алкильных заместителей, стабилизирующих карбкатион, увеличивает реакционная способность О.
О. легко присоединяют галогены с образованием вици-нальных дигалогенидов (F2 присоединяется при −78 °C), константа равновесия реакции иодирования очень мала. Для галогенов, особенно для Br2, характерно анти-присоединение, идущее через стадию образования мостикового иона.
В полярных средах галогеноводороды реагируют с О. с образованием алкилгалогенидов (см. галогензамещенные углеводородов, галогенирование, гидрогалогенирование). Присоединение по двойной связи HClO и HBrО приводит к хлор- и бромгидринам.
Важное пром. значение имеет гидратация О., которая идет в присутствии кислотных катализаторов, напр. H2SO4. Так, в промышленности из этилена и пропилена получают этиловый и изопропиловый спирты.
В присут. AlCl3, BF3, HF и др. кислотных катализаторов О. способны алкилировать насыщ. углеводороды; образующиеся алканы разветвленного строения применяют в качестве высокооктановых добавок к моторным топливам. В условиях реакции Фриделя — Крафтса этилен алкилирует бензол до этилбензола-полупродукта при синтезе стирола. При алкилировании бензола пропиленом образуется кумол, используемый для получения фенола и ацетона (см. алкилирование).
О. вступают в реакции электроф. присоединения со спиртами, кислотами, солями переходных металлов (Hg2+ , Tl3+ , Pb4+ ), NOCl, N2O3, N2O4, IN3 и др. О. вступают в реакцию гидроборирования: 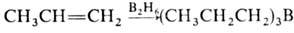 . Образующийся триалкилбор м. б. легко окислен H2O2 в щелочной среде до соответствующего спирта. При взаимодействии О. с формальдегидом образуются диолы или 1,3-диоксаны (Принса реакция), при гидроформилировании — альдегиды. В присут. кислотных катализаторов при повышенной температуре происходит миграция двойной связи α-олефинов в
. Образующийся триалкилбор м. б. легко окислен H2O2 в щелочной среде до соответствующего спирта. При взаимодействии О. с формальдегидом образуются диолы или 1,3-диоксаны (Принса реакция), при гидроформилировании — альдегиды. В присут. кислотных катализаторов при повышенной температуре происходит миграция двойной связи α-олефинов в 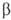 -положение, при этом возможна также изомеризация углеродного скелета. Протонные кислоты и кислоты Льюиса могут вызывать катионную полимеризацию О. Этилен в этих условиях полимеризуется с трудом; пропилен и изобутилен в безводных средах образуют полимеры с очень длинными цепями. В присут. 60%-ной H2SO4 изобутилен димеризуется, гидрирование димера приводит к изооктану.
-положение, при этом возможна также изомеризация углеродного скелета. Протонные кислоты и кислоты Льюиса могут вызывать катионную полимеризацию О. Этилен в этих условиях полимеризуется с трудом; пропилен и изобутилен в безводных средах образуют полимеры с очень длинными цепями. В присут. 60%-ной H2SO4 изобутилен димеризуется, гидрирование димера приводит к изооктану.
Для О. характерны также реакции радикального присоединения по двойной связи. При взаимодействии О. со своб. радикалом может идти полимеризация по цепному механизму (см. цепные реакции, радикальная полимеризация) или присоединение:
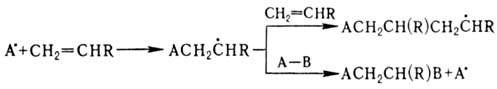
Соотношение между продуктами полимеризации и присоединения зависит от природы О. и реагента, а также их концентрации. Полимеризация идет в том случае, если стадия переноса экзотермична, а О. склонен к образованию устойчивых радикальных продуктов. В случае несимметричного О. радикал на первой стадии присоединяется к менее замещенному атому С. Этим объясняется радикальное присоединение HBr к О. в присутствии пероксидов против правила Марковникова; аналогично присоединяются спирты, амины, CCl4, СBr4. Свободнорадикальная полимеризация этилена в промышленности проводится при давлении 100 МГПа или более и температуре выше 100 °C, процесс инициируется пероксидами или O2 в следовых количествах. Пропилен и изобутилен по радикальному механизму полимеризуются плохо.
на первой стадии присоединяется к менее замещенному атому С. Этим объясняется радикальное присоединение HBr к О. в присутствии пероксидов против правила Марковникова; аналогично присоединяются спирты, амины, CCl4, СBr4. Свободнорадикальная полимеризация этилена в промышленности проводится при давлении 100 МГПа или более и температуре выше 100 °C, процесс инициируется пероксидами или O2 в следовых количествах. Пропилен и изобутилен по радикальному механизму полимеризуются плохо.
Реакции нуклеоф. присоединения для О. менее характерны и идут лишь с сильными нуклеофилами, напр. с металлоорг. соед. типа бутиллития. К реакциям нуклеоф. присоединения м. б. отнесена также анионная полимеризация О. с применением катализаторов Циглера — Натты. В промышленности таким способом получают высокомол. полиэтилен, стереорегуляр-ный изотактич. полипропилен и этилен-пропиленовый каучук.
Присоединение H2 к О. на гетерог. катализаторах (метал-лич. мелкодисперсные Ni, Pt, Pd) приводит к соответствующим алканам (см. гидрирование). Последние образуются также при реакции О. с диимином.
Для О. характерны реакции метатезиса и циклоприсоединения. К последним относятся реакции циклопропанирования карбенами, 1,3-диполярного циклоприсоединения и диеновый синтез.
При окислении О. в зависимости от условий реакции образуются разл. продукты. В мягких условиях в слабощелочной среде KMnO4 окисляет О. до гликолей (Вагнера реакция). Аналогично действует OsO4 в органических растворителях. В кислой среде окисление KMnO4 приводит к смеси кетонов и карбоновых кислот. В более жестких условиях при окислении йодной кислотой в присутствии OsO4 происходит расщепление молекулы О. по двойной связи с образованием смеси карбонильных соединений. Такие же продукты образуются после разложения озонидов при озонировании О. (см. озонирование). Эти реакции позволяют установить положение двойной связи в молекуле. В присут. Ag2O при 200–300 °C О. взаимод. с O2 с образованием эпоксисоединсний, в промышленности таким способом получают этилен- и пропиленоксиды. При действии на О. надкислот (Прилежаева реакция) или H2O2 в ацето-нитриле эпоксиды образуются количественно. При окислении этилена и пропилена кислородом воздуха в присутствии CuCl2 и PdCl2 образуются соотв. ацетальдегид и ацетон.
Для О. характерны реакции окисления по аллильному (соседнему с двойной связью) атому С. В промышленности газофазным окислением пропилена получают акролеин, окислит. аммо-нолиз которого приводит к акрилонитрилу. При хлорировании при высоких температурах (400–600 °C) образуются аллилхлориды. Аллильное замещение происходит также при взаимодействии О. с N-бромсукцинимидом в CCl4 в присутствии пероксидов (см. Воля — Циглера реакция). Эти реакции идут по радикальному механизму.
Осн. пром. способы получения О. — процессы деструктивной переработки нефтепродуктов и прир. газа. Низшие О. C2-C4 получают пиролизом прямогонного бензина, этана, пропана или газойля при 750–900 °C (см. пиролиз нефтяного сырья); пропилен и бутен образуются при каталитич. крекинге вакуумного газойля. Газы пиролиза и крекинга разделяют дробной адсорбцией и низкотемпературной ректификацией под давлением. Разработаны методы получения этилена и пропилена из CH3OH на цеолитных катализаторах. Линейные a-олефины C6-C20 получают термич. крекингом парафиновой фракции, содержащей нормальные алканы состава C14-C34 при 550 °C.
В лаб. условиях О. получают дегидратацией спиртов над Al2O3 и ThO2 при 400 °C или с помощью водоотнимающих агентов (H2SO4, P2O5); дегидрогалогенированием галогено-производных углеводородов (спиртовой раствор щелочи); де-галогенированием вицинальных дигалогеналканов [NaI в CH3OH, Zn, соли Cr(Н) или Na2S2O3 в ДМСО]; разложением четвертичных аммониевых основании (см. Гофмана реакции); термич. разложением эфиров карбоновых кислот и ксанто-геновой кислоты (Чугаева реакция); восстановит. сочетанием альдегидов и кетонов при обработке LiAlH4 и TiCl3, напр. (CH3)2СО → (CH3)2C=C(CH3)2; гидрированием ацетиленовых углеводородов или дегидрированием алканов; по Виттига реакции карбонильных соед. с алкилиденфосфоранами образуются селективно цис-олефины. О. могут быть получены наряду с N,N-дизамещенным гидроксиламином термич. разложением N-оксидов третичных аминов (Коупа реакция):
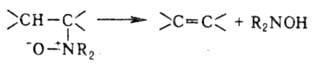
Качеств. определение О. проводят по обесцвечиванию раствора Br2 в CCl4 или по реакции Вагнера, количественное — бромированием смесью KBrO3 и KBr в присутствии H2SO4 с послед. добавлением избытка KI и оттитровыванием выделившегося иода Na2S2O3.
О.-осн. исходные реагенты в хим. промышленности. Из этилена и пропилена получают разл. полимеры и эластомеры, эпоксисоединения, дихлорэтан, винилхлорид, этанол, изо-пропанол, стирол и т. д. Изобутилен — сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ. Его сополимеры с бутенами применяют как присадки к маслам и герметики. a-Олефины состава C10-C18 применяют при синтезе ПАВ (алкилбензолсульфонаты, олефинсульфонаты, алкилсульфо-наты), а также для получения высших спиртов.
Мировой объем производства О. ок. 70 млн. т (1985).
Лит.: Роберте Д. Д., Касерио М. К., Основы органической химии, пер. с англ., т. 1, М., 1978; Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 169–232.
А. А. Братков
Значения в других словарях
- Олефины — Алкены, гомологический ряд ненасыщенных углеводородов общей формулы CnH2n с открытой цепью и одной двойной углерод-углеродной связью; относятся к ациклическим соединениям (См. Ациклические соединения). Родоначальник ряда Этилен CH2 = CH2, поэтому... Большая советская энциклопедия
- олефины — ОЛЕФИНЫ мн. oléfiant ou oléifiant, нем. Olefinen. хим. Класс органических соединений, углеводороды алифатического ряда, служащие сырьем в производстве полимеров. Крысин 1998. Олеофин. Чураев 1910 2 401.- Лекс. СИС 1985: олефины. Словарь галлицизмов русского языка
- ОЛЕФИНЫ — ОЛЕФИНЫ, см. АЛКАНЫ. Научно-технический словарь
- Олефины — (хим.). — До недавнего времени под О. подразумевались вообще углеводороды общей формулы СnН2n. Получение триметилена и других полиметиленовых (см. Энциклопедический словарь Брокгауза и Ефрона
- ОЛЕФИНЫ — ОЛЕФИНЫ (алкены) — ненасыщенные ациклические углеводороды, содержащие в молекуле одну двойную связь C=C. Первый член ряда олефинов — этилен CH2=CH2, поэтому олефины называются также этиленовыми углеводородами. Большой энциклопедический словарь
