олефинов оксиды
ОЛЕФИНОВ ОКСИДЫ (оксираны, алкиленоксиды, a-окиси)
соед. общей формулы I, где R — R''' = Н, Alk, Ar.
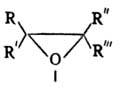
Называют О. о. как производные простейшего О. о. — оксирана (этиленоксида, в формуле I R-R''' = Н) или по назв. соответствующего олефина, напр. метилоксиран, или пропиленоксид. О. о., кроме этиленоксида,-жидкости или твердые вещества (см. табл.) с легким эфирным запахом; хорошо раств. в органических растворителях, низшие — в воде. По сравнению с простыми эфирами или углеводородами близкой мол. массы О. о. кипят при более высоких температурах. В ИК спектре характеристич. полосы поглощения в области 1250см−1 (валентные колебания кольца), 950–810 см−1 и 840–750 см−1.
Длина связи C—C 0,147 нм, C—O 0,144 нм, внутр. угол СОС 61°24'; для этиленоксидаμ 6,27∙10−30 Кл∙м.
СВОЙСТВА НЕКОТОРЫХ ОКСИДОВ ОЛЕФИНОВ
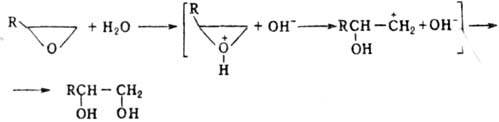
Хим. свойства О. о. определяются их высокой реакц. способностью, связанной с относит, легкостью размыкания напряженного 3-членного цикла. Для О. о. характерны реакции присоединения, протекающие с разрывом цикла гл. обр. по связи C—O. Так, нагревание О. о. с водой в присутствии кислотных и основных катализаторов протекает с образованием гликолей. В первом случае оно идет через промежут. оксониевый катион:
При нуклеоф. атаке реакция идет через промежут. алкоксидный анион с послед. присоединением протона:
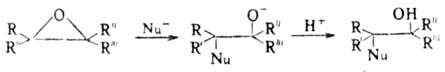
При этом направление атаки зависит от кислотности среды. Так, для алкилзамещенных О. о. в кислой среде атака идет по наиб. замещенному атому С, в основной или нейтральной — по наим. замещенному. Стереоселективность раскрытия цикла зависит также от стерич. факторов и полярности растворителя.
С галогеноводородами О. о. образуют галогенгидри-ны, со спиртами-простые эфиры гликолей, с NH3 и аминами — аминоспирты.
О. о. при нагр. или в присутствии некоторых катализаторов изомеризуются в альдегиды или кетоны. Так, при изомеризации этиленоксида образуется ацетальдегид, при изомеризации пропиленоксида — смесь пропионового альдегида, ацетона и аллилового спирта. Соотношение продуктов зависит от условий реакции: при 240–280 °C в присутствии паров воды, SiO2, Al2O3 или квасцов в реакц. смеси содержится ок. 85% пропионового альдегида; при катализе Li3PO4 при 250 °C содержание аллилового спирта увеличивается.
При восстановлении LiAlH4 обычно преобладает атака по наим. замещенному атому оксиранового цикла. Над никелевыми и др. катализаторами при большом избытке H2 с добавлением до 10% водяного пара идет гидрирование в соответствующий вторичный спирт.
О. о. при нагр. в присутствии катализаторов катионной и анионной полимеризации (напр., металлоорг. соед., щелочей, аминов, кислот Льюиса и т. д.) превращаются в простые полиэфиры (см. также полиэтиленоксид), напр.:
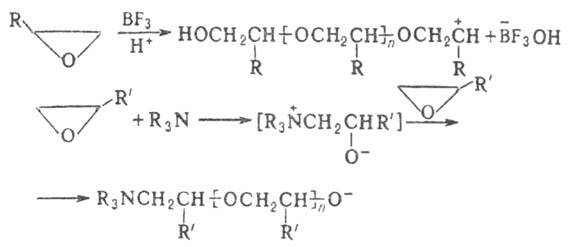
Наиб. высокомол. полимеры образуются при анионной полимеризации в присутствии гетерог. катализаторов — щел.-зем. металлов, оксидов Mg, Be, амидов, карбонатов и сульфатов Ca, Sr и Ва.
Получают О. о. эпоксидированием — гл. обр. окислением олефинов орг. надкислотами (надуксусной, надпропионовой и др.) по Прилежаева реакции. Эпоксидирование олефинов осуществляют иногда с использованием гидропероксидов этилбензола, изопропилбензола в присутствии более легко окисляемых соед., напр., альдегидов. В последнем случае активный кислород окисляет альдегид в пероксид, реагирующий затем с олефином. В пром. масштабе эти методы используют для получения пропиленоксида.
Применяют также и др. методы эпоксидирования, напр. Дарзана реакцию и циклодегидрогалогенирование a-хлор-гидринов под действием щелочей:
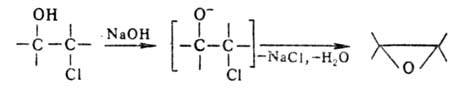
Др. препаративные методы получения О. о. — дегидратация а-гликолей, конденсация диазометана с кетонами или альдегидами. Особое место занимает гетерог. окисление этилена на серебряном катализаторе, используемое как пром. способ получения этиленоксида. В пром. масштабе получают также оксиды стирола и бутилена.
Токсичность низших О. о. значительна и, как правило, снижается с увеличением мол. массы.
О. о. — исходные вещества для получения эпоксидных смол, полимеров, ряда лек. препаратов; применяются в орг. синтезе.
Лит.: Малиновский М. С., Окиси олефинов и их производные, М., 1961; Общая органическая химия, пер. с англ., т. 2, М., 1982, с. 376–391; Comprehensive heterocyclic chemistry, ed. by A. R. Katrizky, v. 7, N. Y.-[a. o.], 1984, p. 95–129; Kirk-Olhmer encyclopedia, 3 ed., v. 9, N.Y., 1980, p. 251–56.
Б. Б. Чесноков
