перманганатометрия
ПЕРМАНГАНАТОМЕТРИЯ
титриметрич. метод анализа, основанный на реакциях: 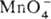 + 8H+ + 5е
+ 8H+ + 5е 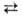 4H2O + Mn2+ и
4H2O + Mn2+ и 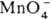 + 4H2O + Зе ⇄ MnO2 + 4OH− (стандартные электродные потенциалы соотв. +1,52 и +0,57 В). Титрантом служит водный раствор KMnO4, который в чистом виде очень устойчив и долго хранится. Однако в присутствии Mn(II) происходит реакция:
+ 4H2O + Зе ⇄ MnO2 + 4OH− (стандартные электродные потенциалы соотв. +1,52 и +0,57 В). Титрантом служит водный раствор KMnO4, который в чистом виде очень устойчив и долго хранится. Однако в присутствии Mn(II) происходит реакция: 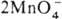 + 3Mn2+ + 2H2O
+ 3Mn2+ + 2H2O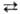 5MnO2 + 4H+, которая ускоряется диоксидом марганца и при понижении кислотности раствора. Поскольку перманганат калия всегда содержит трудно удаляемые примеси, свежеприготовленный раствор KMnO4 кипятят в течение часа, фильтруют через стеклянный фильтр и хранят в темных склянках, в защищенных от прямого солнечного света местах (т. к. на свету ускоряется разложение KMnO4 на MnO2 и O2).
5MnO2 + 4H+, которая ускоряется диоксидом марганца и при понижении кислотности раствора. Поскольку перманганат калия всегда содержит трудно удаляемые примеси, свежеприготовленный раствор KMnO4 кипятят в течение часа, фильтруют через стеклянный фильтр и хранят в темных склянках, в защищенных от прямого солнечного света местах (т. к. на свету ускоряется разложение KMnO4 на MnO2 и O2).
Для определения концентрации титранта используют растворы с точно известным содержанием (стандартные растворы) Na2C2O4, As2O3 (в присут. ICl или KIO3 в качестве катализатора), FeS04∙(NH4)2SO4∙6H2O и K4[Fe(CN)6]∙3H2O. Конечную точку титрования в П. устанавливают обычно визуально без индикатора по появлению или исчезновению окраски перманганат-иона (даже 2∙10−6 M раствор KMnO4 имеет отчетливую розовую окраску), потенциометрически или амперометрически. При обратном титровании к исследуемому раствору приливают раствор KMnO4, избыток которого от-титровывают раствором восстановителя, напр. щавелевой кислоты.
П. применяют для определения Fe(II), Sb(III), Mn(II), V(IV), W(V), U(IV), Tl(I), Cr(III), H2O2, H2C2O4 и ее солей, арсенитов, гидразина и ряда орг. веществ (напр., хлоруксусной и пропионовой кислот в щелочной среде); обратным пермангана-тометрич. титрованием определяют восстановители, медленно реагирующие с KMnO4, — иодиды, цианиды, родани-ды, фосфиты.
П. используют также для косвенных определений. Например, концентрации очень сильных восстановителей, окисляющихся в обычных условиях растворенным кислородом, — Cr (II), V(II), Ti(III), Nb(III), Mo(III), Cu(I), Sn(II) и др. — устанавливают после их взаимод. с ионами Fe(III) по количеству образовавшихся ионов Fe (II), которые оттитровывают раствором KMnO4. Ионы таких металлов, как Ca, Cd, Zn, Pb(Il), Со, Ni, РЗЭ, определяют после их осаждения в виде оксалатов. К П. часто относят обратное ферриметрич. титрование, в котором при определении окислителей (дихроматов, персульфатов, ванадатов, MnO2, PbO2, Pb3O4 и др.) их предварительно восстанавливают с помощью Fe(II), избыток которого оттитровывают раствором KMnO4.
Лит.: Объемный анализ, пер. с англ., т. 3, М., 1961, с. 41–72; Лайти-нен Г. А., Харрис В. E., Химический анализ, пер. с англ., 2 изд., М., 1979.
Г. В. Прохорова
Значения в других словарях
- Перманганатометрия — (от Перманганаты и ...метрия (См. …метрия)) метод химического титриметрического анализа (См. Титриметрический анализ), основанный на применении растворов перманганата калия (См. Перманганат калия) (KMnO4) для количественных объёмных определений (см. Большая советская энциклопедия
- перманганатометрия — орф. перманганатометрия, -и Орфографический словарь Лопатина
- ПЕРМАНГАНАТОМЕТРИЯ — ПЕРМАНГАНАТОМЕТРИЯ — титриметрический метод количественного анализа, основан на окислении исследуемого вещества перманганатом калия. Большой энциклопедический словарь
