пероксидные соединения неорганические
ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ НЕОРГАНИЧЕСКИЕ
содержат группировку из связанных между собой двух атомов О. Употребляют также назв. дикислородные соединения. Общее свойство большинства пероксидных соед. (П.с.) — способность сравнительно легко выделять кислород (при нагр., при действии воды или др. веществ), поэтому иногда говорят, что кислород в них присутствует в активной форме и наз. его активным кислородом.
Различают ионные и ковалентныеП.с. Дикислород-ная группировка может существовать в трех ионных формах, поэтому ионные П. с. подразделяют на три осн. группы: пероксиды с ионом 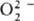 ; супероксиды (гипероксиды) с ионом
; супероксиды (гипероксиды) с ионом 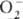 ; диоксигенильные соединения с ионом
; диоксигенильные соединения с ионом 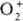 . К ионным П. с. относят также озониды неорганические, гидропе-роксиды и соли пероксония, содержащие соотв. ионы
. К ионным П. с. относят также озониды неорганические, гидропе-роксиды и соли пероксония, содержащие соотв. ионы 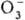 ,
, 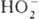 ,
, 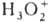 . Среди ионных П. с. только пероксиды диамагнитны и не окрашены (или их окраска не связана с пероксид-ной группой), остальные парамагнитны и, как правило, ярко окрашены.
. Среди ионных П. с. только пероксиды диамагнитны и не окрашены (или их окраска не связана с пероксид-ной группой), остальные парамагнитны и, как правило, ярко окрашены.
Ковалентные П. с. имеют общую формулу R—O—O—R', где R и R' — неорг. радикалы или атомы. К этой группе относят водорода пероксид, пероксокислоты, пероксосольваты, хлор-перокситрифторметан CF3OOCl, соед. с цепочкой из трех атомов О, напр. CF3OOOCF3, и др. Ионы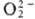 и
и 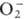 могут образовывать координац. связи с ионами переходных и непереходных элементов, соответствующие соед. входят в группу комплексных П. с., близких по свойствам к ковалентным П. с. Диоксидифторид O2F2, соед. с цепочкой из трех атомов О (напр., CF3OOOCF3) и некоторые другие также можно отнести к П. с. К комплексным П. с. следует отнести соед., обратимо отдающие кислород,-комплексы с мол. кислородом, важнейший из которых-оксигемоглобин. Энергия, длина и порядок связи O—O в молекуде П.с, зависят от заряда на группе O2 (табл. 1).
могут образовывать координац. связи с ионами переходных и непереходных элементов, соответствующие соед. входят в группу комплексных П. с., близких по свойствам к ковалентным П. с. Диоксидифторид O2F2, соед. с цепочкой из трех атомов О (напр., CF3OOOCF3) и некоторые другие также можно отнести к П. с. К комплексным П. с. следует отнести соед., обратимо отдающие кислород,-комплексы с мол. кислородом, важнейший из которых-оксигемоглобин. Энергия, длина и порядок связи O—O в молекуде П.с, зависят от заряда на группе O2 (табл. 1).
Табл. 1. ХАРАКТЕРИСТИКА СВЯЗИ O—O
таблица в процессе добавления
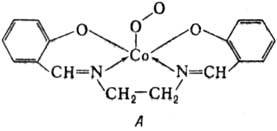
Примеры П.с. — ионные пероксиды и гидропероксиды Na2O2, BaO2, NH4OOH; координац. пероксиды и гидропероксиды [Nb(O2)] 3−, [Ti(O2)F5] 3−, [BF3OOH]−; пероксокислоты и их соли H2CO4, KHSO5; пероксосольваты Na2CO3∙1,5H2O2, СО(NH2)2∙H2O2; соли пероксония H3O2+AsF6−, H3O2+SbF6− ; ионные супероксиды NaO2, KO2, Са(O2)2; координац. супероксиды [Co(O2)(CN)5]3−, [{Co(NH3)5}2(O2)]5+ ; озониды KO3, RbO3, CsO3; комплексы с мол. кислородом-соед. формулы А ("салькомин"); соли диоксигенила O2BF4, O2PtF6.
Пероксиды. Пероксиды щелочных металлов М2O2 — бесцветные кристаллы, решетка которых построена из ионов O22− и M+ (табл. 2). В водном растворе полностью гидролизуют-ся до MOH и H2O2, в случае П. с. Li и Na гидролиз в значит. степени обратим; из водно-пероксидного раствора кристаллизуются пероксосольваты, напр. Li2O2∙2H2O2, Na2O2∙2H2O2∙4H2O.
Известны также K2O2∙nH2O2 (n= 2,4). Состав сольватов определяется температурой и концентрацией H2O2 и щелочи в растворе. M2O2 реагируют с парами воды и с CO2, выделяя O2 и образуя MOH и M2CO,- Активность M2O2 в этой реакции растет от Li2O2 к Cs2O2. На этой реакции основано применение Li2O2 и Na2O2 в качестве компонентов регенеративных веществ в дыхат. аппаратах изолирующего типа. M2O2-довольно активные окислители, мн. орг. вещества (спирты, эфиры и др.) воспламеняются в контакте с ними.
Табл. 2. — СВОЙСТВА ПЕРОКСИДОВ МЕТАЛЛОВ
таблица в процессе добавления
Пром. способом производят только натрия пероксид и немного Li2O2(Hs LiOH и H2O2 в воде с послед. сушкой сольвата).
Пероксиды элементов II группы MO2 образуют все щел.-зем. металлы. Бесцв. кристаллы, малогигроскопичны. Температура распада MO2 растет от Mg к Ba, причем в случае соед. Ba и Sr реакция MO2 ⇄ МО + l/2O2 обратима; давление диссоциации p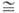 0,1 МПа для BaO2 при 843 °C, для SrO2 при 365 °C. MgO2 и CaO2 необратимо разлагаются при 330–430 °C.
0,1 МПа для BaO2 при 843 °C, для SrO2 при 365 °C. MgO2 и CaO2 необратимо разлагаются при 330–430 °C.
Пероксиды щел.-зем. металлов как твердые окислители и оксигенирующие агенты химически менее активны, чем пероксиды щелочных металлов, их реакционная способность проявляется при повышенных температурах. В отсутствие влаги BaO2 реагирует с N2O с образованием Ba (NO2) 2 и N2 при 500–600 °C, с NO2, давая Ba(NO3)2, при 120–140 °C, с NH3 выше 500 °C. В присут. паров воды эти реакции, а также поглощение CO2 идут при более низкой температуре. BaO2 окисляет оксиды металлов при 230–430 °C с образованием солей Ba или смешанных оксидов; напр., с Cr2O3 дает BaCrO4, с MnO5 Mn3O4 и MnO2-BaMnO4.
Пероксиды щел.-зем. металлов устойчивы к действию воды, их гидролиз протекает медленно; из растворов H2O2 в воде или M (OH)2 и H2O2 в воде они кристаллизуются в виде кристаллогидратов и пероксосольватов состава MO2∙ 8H2O, MO2∙2H2O2 и MO2∙H2O2. Октагидраты довольно устойчивы, теряют воду ок. 400 °C без разложения. Пероксосольваты менее устойчивы, их термич. распад в вакууме протекает по двум параллельным направлениям-отщепление и разложение кристаллизационной H2O2 и диспропорциони-рование по схеме 2(MO2∙2H2O2) → M(O2)2+M(OH)2+3H2O+1,5O2.
Макс. содержание M(O2)2 в смеси в случае Ba ~ 10%, в случае Sr ~ 30%, Ca до 60%, Mg ок. 1%.
Пероксиды щел.-зем. металлов получают реакцией их гидроксидов с водной H2O2 или взаимод. раствора H2O2 с растворами солей в присутствии NH3 с послед. сушкой выпавшего сольвата. При получении MgO2 из Mg(OH)2 концентрация раствора H2O2 более 30%, после сушки препараты содержат не менее 0,5 моля H2O на моль MgO2. BaO2 получают также реакцией BaO с O2 воздуха при 330–530 °C. BaO2, CaO2 и небольшие количества MgO2 производят в пром. масштабе. BaO2 (см. также бария оксид) — компонент трассирующих составов, капсюлей-детонаторов и запалов замедленного действия, BB, термитных смесей, твердых источников O2, катализаторов полимеризации олефинов. CaO2 применяют для очистки сточных вод, для отбеливания бумаги и пряжи, в хлебопечении для улучшения пластич. свойств теста, в качестве добавки к удобрениям для рисовых плантаций, в составе регенеративных веществ, для вулканизации полисульфидных каучуков и др. MgO2 входит в состав антисептич. средств и отбеливающих композиций. Все пероксиды служат, кроме того, эффективными бактерицидными, спороцидными и деконтаминирую-щими средствами.
Пероксиды Zn и Cd имеют кремовую окраску, вызванную, по-видимому, примесью супероксидов. Получают их действием H2O2 на оксид, гидроксид или водно-аммиачный раствор соли Zn или Cd, ZnO2-также реакцией Zn(NO3)2 с NaO2 в жидком аммиаке. ZnO2-компонент мазей для лечения ран и ожогов, для предотвращения газовой гангрены; используется при вулканизации и полимеризации. Пероксид HgO2 известен в двух модификациях — желтой a, взрывающей при нагр. и ударе, и более стабильной красно-оранжевой β.
Гидропероксиды 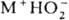 — кислые соли H2O2; малостабильны; присутствуют в щелочных водных растворах H2O2. В кристаллич. состоянии надежно установлено существование только
— кислые соли H2O2; малостабильны; присутствуют в щелочных водных растворах H2O2. В кристаллич. состоянии надежно установлено существование только 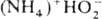 (т. пл. 22–23 °C, при 45 °C полностью разлагается на NH3, H2O и O2). Вопрос о принадлежности др. соединений эмпирич. формулы MOOH, где M-щелочной металл или (Alk)4N+, к гидропероксидам или пероксосольватам M2O2∙H2O2 не решен.
(т. пл. 22–23 °C, при 45 °C полностью разлагается на NH3, H2O и O2). Вопрос о принадлежности др. соединений эмпирич. формулы MOOH, где M-щелочной металл или (Alk)4N+, к гидропероксидам или пероксосольватам M2O2∙H2O2 не решен.
Супероксиды. Супероксиды щелочных металлов MO2-кристаллы (табл. 3), окрашены в разл. оттенки желтого цвета; термохроны — с ростом температуры интенсивность окраски усиливается, а ниже 100 К окраска почти исчезает; полиморфны. NaO2 и KO2 немного раств. в жидком NH3, а в присутствии краун-эфиров KO2 хорошо раств. в ДМСО и др. неводных средах.
Табл. 3. СВОЙСТВА СУПЕРОКСИДОВ ЩЕЛОЧНЫХ МЕТАЛЛОВ
таблица в процессе добавления
LiO2 термически неустойчив, в индивидуальном виде не выделен; образуется при действии O3 на суспензию Li2O2 в хладоне 12 ниже 170 К или в аргоновой матрице при совместной конденсации паров Li и O2 при 14 К. Остальные MO2 при комнатной температуре в отсутствие влаги и CO2 вполне стабильны. Термич. распад MO2 идет через промежут. образование M2O2 и твердых растворов MO2 в M2O2, стадия 2MO2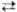 M2O2 + O2 обратима. При 157 °C время полураспада 6 сут, при 252 °C — ок. 1 ч, добавки V2O5 заметно ускоряют распад. Скорость термич. распада NaO2 зависит также от дефектности кристаллов. KO2, RbO2 и CsO2 более устойчивы, разлагаются при 390–600 °C. Температуры плавления супероксидов MO2 можно определить только под давлением O2; только для KO2 относительно надежно измерена т. пл. 511 °C. Реакция MO2 с избытком воды идет по схеме: 2MO2 + 2H2O
M2O2 + O2 обратима. При 157 °C время полураспада 6 сут, при 252 °C — ок. 1 ч, добавки V2O5 заметно ускоряют распад. Скорость термич. распада NaO2 зависит также от дефектности кристаллов. KO2, RbO2 и CsO2 более устойчивы, разлагаются при 390–600 °C. Температуры плавления супероксидов MO2 можно определить только под давлением O2; только для KO2 относительно надежно измерена т. пл. 511 °C. Реакция MO2 с избытком воды идет по схеме: 2MO2 + 2H2O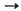 2MOH + H2O2 + O2, в присутствии катализатора, напр. MnO2, и при повышенной температуре-по схеме: 2MO2 + H2O → 2MOH + 3/2O2 с выделением 305 л O2 на 1 кг NaO2 и 236 л O2 на 1 кг KO2. Супероксиды Na и К реагируют с влажным CO2 при ~ 20 °C с выделением всего активного O2 и образованием карбонатов, однако в отсутствие паров воды реакция с CO2 начинается лишь при ~ 100 °C. NaO2 и KO2 с CO при 100–180 °C образуют карбонаты, с SO2 в присутствии небольшого количества паров воды-M2SO4, при ~20 °C с NO2-MNO3; раств. в расплавах фторидов и нитратов щелочных металлов, напр. т. пл. эвтектич. сплава KO2 (34 мол. %) с KNO3 222 °C. Под действием O3 или атомарного О супероксиды MO2 превращ. в озониды MO3. Выделены супероксиды тетраалкиламмония, напр.: [(CH3)4N]O2 и [(C2H3]4N]O2-кристаллы; устойчивы ниже 60 °C, при нагр. взрывают; хорошо раств. в жидком NH3 и органических растворителях.
2MOH + H2O2 + O2, в присутствии катализатора, напр. MnO2, и при повышенной температуре-по схеме: 2MO2 + H2O → 2MOH + 3/2O2 с выделением 305 л O2 на 1 кг NaO2 и 236 л O2 на 1 кг KO2. Супероксиды Na и К реагируют с влажным CO2 при ~ 20 °C с выделением всего активного O2 и образованием карбонатов, однако в отсутствие паров воды реакция с CO2 начинается лишь при ~ 100 °C. NaO2 и KO2 с CO при 100–180 °C образуют карбонаты, с SO2 в присутствии небольшого количества паров воды-M2SO4, при ~20 °C с NO2-MNO3; раств. в расплавах фторидов и нитратов щелочных металлов, напр. т. пл. эвтектич. сплава KO2 (34 мол. %) с KNO3 222 °C. Под действием O3 или атомарного О супероксиды MO2 превращ. в озониды MO3. Выделены супероксиды тетраалкиламмония, напр.: [(CH3)4N]O2 и [(C2H3]4N]O2-кристаллы; устойчивы ниже 60 °C, при нагр. взрывают; хорошо раств. в жидком NH3 и органических растворителях.
Супероксиды щел.-зем. металлов М(O2)2 образуются в смеси с M(OH)2 и MO2 при вакуумно-термич. обработке MO2∙2H2O2, где M = Ca, Sr, Ba. Термич. устойчивость M(O2)2 тем ниже, чем выше содержание его в смеси. Для Ca(O2)2 рассчитаны 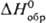 и
и 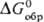 соотв. −395 и −322 кДж/моль. По окраске и химическим свойствам супероксиды щел.-зем. и щелочных металлов похожи, но первые менее активны.
соотв. −395 и −322 кДж/моль. По окраске и химическим свойствам супероксиды щел.-зем. и щелочных металлов похожи, но первые менее активны.
В промышленности KO2 получают реакцией К с O2 ок. 327 °C (расплавл. К с помощью форсунки впрыскивают в воздух, обогащенный O2). Аналогично можно синтезировать RbO2 и CsO2, но не NaO2, который получают медленным нагреванием Na2O2 до 230–430 °C в автоклаве при давлении O2 10–15 МПа.
Продукт содержит 85–95% NaO2; более чистый NaO2 м. б. получен действием O2 на Na в среде 1, 2-димет-оксиэтана в присутствии флуорена или бензофенона при нормальных условиях. NaO2 и KO2 — компоненты регенеративных веществ, используемых для поддержания постоянного состава атмосферы в замкнутых обитаемых помещениях.
Пероксокислоты. Неустойчивы и в своб. состоянии, и в водном растворе, но соли некоторых из пероксокислот стабильны. Пероксобораты — наиб. многочисл. группа солей пероксокислот. Известны два пероксокарбонатных аниона — пероксо-монокарбонат 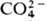 и пероксидикарбонат
и пероксидикарбонат 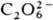 . Их щелочные соли устойчивы в обычных условиях, но распадаются при небольшом нагревании; так, KHCO4 при 60–80 °C экзотермически распадается на K2CO3, CO2, O2 и H2O, K2C2O6 разлагается при 140–160 °C эндотермически на K2CO3, CO2 и O2. Пероксоазотная кислота HNO4 (HOONO2) малоустойчива даже в разб. растворе; ее образование в разреженном газе по реакции HO2 + NO2
. Их щелочные соли устойчивы в обычных условиях, но распадаются при небольшом нагревании; так, KHCO4 при 60–80 °C экзотермически распадается на K2CO3, CO2, O2 и H2O, K2C2O6 разлагается при 140–160 °C эндотермически на K2CO3, CO2 и O2. Пероксоазотная кислота HNO4 (HOONO2) малоустойчива даже в разб. растворе; ее образование в разреженном газе по реакции HO2 + NO2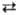 HOONO2 играет важную роль в каталитич. стратосферных циклах, включающих оксиды азота и радикалы НО• и НО•2. Соли HNO4 неизвестны, но ее ковалентные производные ROONO2, где R = CH3CO, CCl3, CF3, вполне стабильны. Соли монопероксофосфорной кислоты H3PO5 не выделены, а пероксополифосфаты известны, напр. Na4P2O8 и K4P2O8. Сера образует две пероксокисло-ты — монопероксосерную H2SO5 (кислота Каро) и более стабильную пероксодисерную H2S2O8, выделенную в своб. состоянии в виде бесцв. кристаллов с т. пл. 65 °C. Пероксокислоты и их соли получают анодным окислением соответствующих простых кислот и солей или реакцией их с H2O2. Пероксосерные кислоты — промежут. продукты при электрохим. получении H2O2 из растворов H2SO4. Пероксокислоты галогенов неизвестны.
HOONO2 играет важную роль в каталитич. стратосферных циклах, включающих оксиды азота и радикалы НО• и НО•2. Соли HNO4 неизвестны, но ее ковалентные производные ROONO2, где R = CH3CO, CCl3, CF3, вполне стабильны. Соли монопероксофосфорной кислоты H3PO5 не выделены, а пероксополифосфаты известны, напр. Na4P2O8 и K4P2O8. Сера образует две пероксокисло-ты — монопероксосерную H2SO5 (кислота Каро) и более стабильную пероксодисерную H2S2O8, выделенную в своб. состоянии в виде бесцв. кристаллов с т. пл. 65 °C. Пероксокислоты и их соли получают анодным окислением соответствующих простых кислот и солей или реакцией их с H2O2. Пероксосерные кислоты — промежут. продукты при электрохим. получении H2O2 из растворов H2SO4. Пероксокислоты галогенов неизвестны.
Пероксосольваты (пероксогидраты, пергидраты, гидропе-роксидаты) — продукты присоединения (в результате образования водородных связей) H2O2 к анионам неорг. или орг. кислот и некоторым нейтральным молекулам. Кристаллы; могут служить твердыми носителями H2O2. Наиб. известны натрия пероксокарбонат Na2CO3∙1,5H2O2 и соед. H2O2 с мочевиной CO(NH2)•H2O2 (гидроперит). Большинство пероксо-сольватов термически неустойчивы, отщепление и распад присоединенной H2O2 происходит при 82–147 °C. При растворении в воде пероксосольваты распадаются на исходные компоненты. Связь H2O2 с анионом кислоты тем прочнее, чем выше отрицат. заряд и меньше число атомов аниона. Известны пероксосольваты фторидов, напр. KF∙n H2O2, где n = 1, 2, 3, оксалатов M2C2O4∙H2O2, сульфатов, напр. (NH4)2SO4∙H2O2, и др. Получают пероксосольваты кристаллизацией из водных растворов, содержащих H2O2 и соответствующую соль. Пероксокарбонат Na и гидроперит производят в промышленности; их растворы применяют для отбеливания, дезинфекции и в др. областях, где используют H2O2.
В очень кислых средах молекула H2O2 присоединяет H и образует пероксониевый катион [HOOH2]+, соли которого H3O2+ AsF6− , H3O2+ Sb2F11−, H3O2+ SbF6− выделены из раствора в безводном HF; все они распадаются при 22–47 °C на O2 и соли H3O+.
Координационные пероксиды и супероксиды. Наиб. характерны соед. с 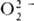 . Один ион металла м. б. координирован с 1–3 и даже 4 ионами
. Один ион металла м. б. координирован с 1–3 и даже 4 ионами 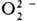 , в последнем случае вся коорди-нац. сфера комплекса занята пероксолигандами, напр.
, в последнем случае вся коорди-нац. сфера комплекса занята пероксолигандами, напр. 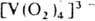
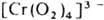 . Пероксокомплексы со смешанными лигандами [MLх(O2)y ]n±, где L-неорг. анион или молекула или орг. донорныи лиганд. Структура металл-ди-кислородных фрагментов в большинстве случаев относится к одному из трех видов: тип I-только для
. Пероксокомплексы со смешанными лигандами [MLх(O2)y ]n±, где L-неорг. анион или молекула или орг. донорныи лиганд. Структура металл-ди-кислородных фрагментов в большинстве случаев относится к одному из трех видов: тип I-только для 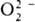 , II — для
, II — для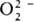 и
и 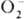 , III для
, III для 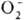 и
и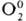
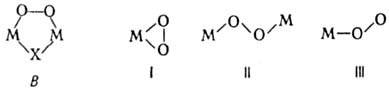
Пероксокомплексы типа I особенно характерны для Cr, Ti, V, Mo, Nb, Zr, Ta, W, Hf, U. Пероксо- и супероксоком-плексы типа II преобладают у Со, Cu, Rh, Ru, Cr, Fe, напр. [{Co(CN)5}2(O2)]5− В некоторых комплексах Cu, Rh, Pt группировка типа II входит в цикл (формула В). Тип III характерен для супероксокомплексов Со, Cr, Ru, Rh, Mn и мн. комплексов Fe, Со, Cu и др. с мол. O2. Суперкомплекс [{Al(CH3)3}2(O2)]− относится к типу III, ковалентные II. с. к типу II. Пероксокомплексы получают взаимод. солей или комплексов соответствующего металла с H2O2, супероксокомплексы-из M+  или прямой реакцией O2 с металлокомплексами. Комплексы с мол. O2 используют для переноса и концентри-рования O2 и для изменения его реакц. способности ("активация лиганда"). Пероксокомплексы Mo и V применяют для -)поксидирования олефинов, напр. в промышленности-для получения пропиленоксида.
или прямой реакцией O2 с металлокомплексами. Комплексы с мол. O2 используют для переноса и концентри-рования O2 и для изменения его реакц. способности ("активация лиганда"). Пероксокомплексы Mo и V применяют для -)поксидирования олефинов, напр. в промышленности-для получения пропиленоксида.
Лит.: Вольнов И. И.. Перекисные соединения щелочных металлов. M.. 1980; его же, Перекисные соединения щелочноземельных металлов, М., 1983.
В. Я. Росоловский
