пинаколиновая и ретропинаколиновая перегруппировки
ПИНАКОЛИНОВАЯ И РЕТРОПИНАКОЛИНОВАЯ ПЕРЕГРУППИРОВКИ
взаимные превращ. 1,2-диолов и карбонильных соед. — альдегидов и кетонов, сопровождающиеся 1,2-миграцией заместителей — атома H или групп атомов.

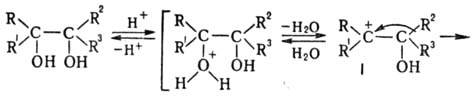
R, R1, R3 -H. алкил, арил, R2-H, алкил, арил, аралкил, ацил. Пинаколиновая перегруппировка (П.п.) — превращение гл. обр. третичных диолов (пинаконов) в кетоны (пинаколины) под действием электроф. реагентов (кислот, их ангидридов и галогенангидридов, ZnCl2 и др.). Отщепление гидроксильной группы вызывает смещение одного из заместителей (R2) к возникающему карбениевому центру; при этом карбкатион I превращ. в более стабильный карбоксо-ниевый катион II, который затем отщепляет H+ и переходит в карбонильное соед.:
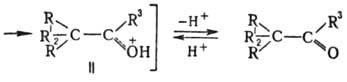
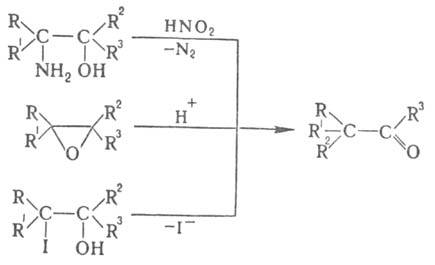
К П. п. относят также превращения вторичных диолов, 1,2-аминоспиртов (пинаколиновое дезаминирование, см. Тиффено реакция), оксиранов, 1,2-галогенгидринов, напр.:
Строение продуктов П. п. определяется способностью заместителей стабилизировать промежут. катионы, стерич. факторами, подвижностью (способностью к миграции) заместителей и условиями среды. Преим. мигрирует группа в перипланарном положении к уходящей группе. П. п. обычно протекают с обращением конфигурации в конечном пункте миграции; в ациклич. системах наблюдается частичная рацемизация; конфигурация мигранта не меняется. В целом стереоселективность П. п. уменьшается с ростом стабильности катионоидных интермедиатов (увеличение вероятности поворота карбениевого центра вокруг C—C связи). П. п. используют для синтеза разл. кетонов, а также соед. со спирановой структурой, напр.:
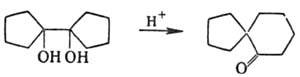
П.п. открыл A.M. Бутлеров в 1873.
При ретропинаколиновых перегруппировках (P. п.) — превращениях α-разветвленных альдегидов и кетонов в 1,2-диолы и их производные — происходит миграция одного из α-заместителей R к атому С карбонильной группы. P. п. возможны, когда термодинамич. стабильность карбо-ксониевого иона II близка к стабильности третичных карбкатионов I, что м. б. достигнуто, напр., при замене группы OH на более сильный акцептор электронов — ацило-ксигруппу. P. п. происходят в результате О-ацилирования альдегидов и кетонов аддуктами ацилхлоридов с кислотами Льюиса в апротонной среде, а также при ионизации a-хлоралкилацилатов III:
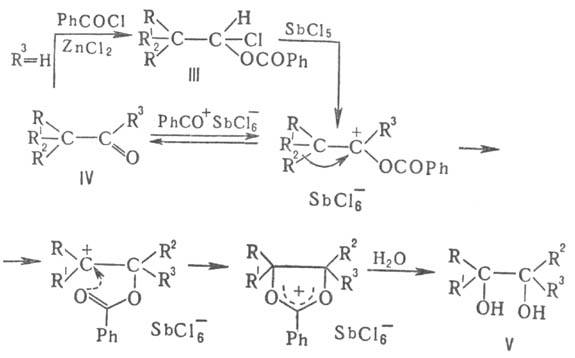
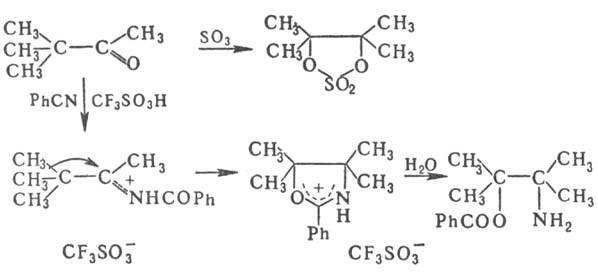
При P. п. 1,3-дикетонов (IV; R2 = ацил, R3 = алкил) и 1,3-кетоальдегидов (IV; R2 = ацил, R3 = H) мигрирует ацил и образуются 2,3-дигидроксикетоны (V; R2 = ацил), т. е. простейшие моносахариды-триозы. Пример P. π-изомеризация пинаколина при действии SO3, а также при его протонировании в среде бензонитрила:
Термин "Р. п." предложил M. Тиффено в 1907 применительно к превращ. пинаколинового спирта в тетраметил-этилен:
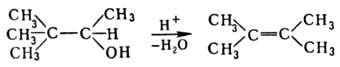
П. п. и P. п. относятся к Вагнера-Меервейна перегруппировкам.
Лит.: Беккер Г., Введение в электронную теорию органических реакций, пер. с нем., М., 1977, с. 541–85; Темникова T. И., Семенова CH., Молекулярные перегруппировки в органической химии, Л., 1983, с. 256; Боро-даев С. В., Лукьянов С. M., Жданов Ю. А., "ДАН СССР", 1986, т. 287, № 4, с. 862–65.
С. М. Лукьянов
