пиразол
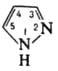
ПИРАЗОЛ (1,2-диазол)
мол. м. 68,08; бесцветные кристаллы со своеобразным запахом; т. пл. 70 °C, т. кип. 185–187 °C; плотн. 1,002 г/см3; 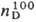 1,4703; μ 7,39∙10−30 Кл∙м; хорошо раств. в воде, хуже — в бензоле и цикло-гексане (соотв. 130,18 и 3 г в 100 мл). Обладает слабыми основными свойствами, амфотерен, рKа 2,47. Молекулы П. плоские и сильно ассоциированы благодаря водородным связям. Для димера П. характерна прототропная таутомерия, приводящая к полной идентичности 3- и 5-замещенных:
1,4703; μ 7,39∙10−30 Кл∙м; хорошо раств. в воде, хуже — в бензоле и цикло-гексане (соотв. 130,18 и 3 г в 100 мл). Обладает слабыми основными свойствами, амфотерен, рKа 2,47. Молекулы П. плоские и сильно ассоциированы благодаря водородным связям. Для димера П. характерна прототропная таутомерия, приводящая к полной идентичности 3- и 5-замещенных:
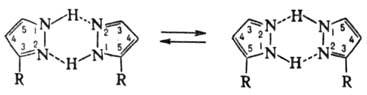
Характер заместителя обычно влияет на положение тауто-мерного равновесия.
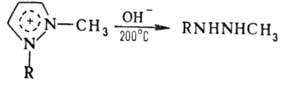
П. обладает ароматич. свойствами, которые связаны с наличием 6p-электронной сопряженной системы. Наиб. электронная плотность в положении 4, наименьшая — в положениях 3 и 5. Реакции электроф. замещения протекают обычно по атому С-4. Алкилирование или ацилирование 1-замещенных П. приводит к смеси 1,3- и 1,5-производных. 1-Замещенные П. образуют четвертичные соли по атому N-2, отщепляющие при нагр. алкильные заместители и распадающиеся при сплавлении со щелочами до 1,2-диалкилгидразинов:
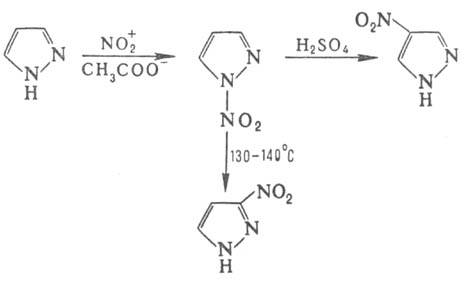
Нитрование П., незамещенных по атому 1 и содержащих в положении 4 электроноакцепторную группу, приводит к 1-нитропроизводным, которые (если положение 4 свободно) при обработке конц. H2SO4 дают 4-нитропиразолы, а при нагр. в высококипящем растворителе претерпевают 1,5-сигматропную перегруппировку с образованием 3-нитропроизвод-ного:
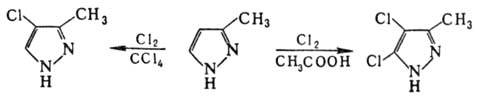
Замещенные П. легко галогенируются под действием разл. агентов в 4-галогенопроизводные; в более жестких условиях м. б. получены дигалогенопроизводные, напр.:
Обмен атомов H. на дейтерий легко протекает в нейтральной среде по положениям 1 и 4, в присутствии оснований-по положениям 3 и 5. Гидрирование П. в присутствии Pd (150 °C, 10 МПа) или восстановление Na в спирте приводит последовательно к 2-пиразолину (формула I) и пиразо-лидину(П):
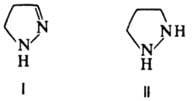
Обратный процесс м. б. реализован при окислении соед. I и II действием Br2 , KMnO4, PbO2 , а также в присутствии S или Se при 200–220 °C.
Получают П. и его производные взаимод. гидразина и его производных с 1,3-дикарбонильными соед., напр.:
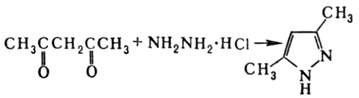
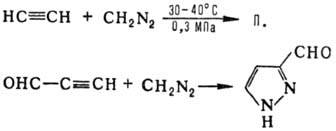
Часто для получения П. используют также 1,3-диполярное присоединение диазоалканов к ацетиленам, напр.:
Идентифицируют П. в виде пикрата (т. пл. 160 °C) или оксалата (т. пл. 192 °C).
П. и его производные-промежут. продукты в синтезе лек. препаратов (гл. обр. на основе 5-пиразолона — анальгин, амидопирин, антипирин) и пестицидов; красители для цветной фотографии, орг. люминофоры.
Лит.: Гетероциклические соединения, под ред. P. Эльдерфилда, пер. с англ., т. 5, М., 1961; Пожарский А. Ф., Теоретические основы химии гетероциклов, М., 1985; Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 429–80.
Я. И. Грандберг
Значения в других словарях
