растворы полимеров
РАСТВОРЫ ПОЛИМЕРОВ
обладают рядом особенностей по сравнению с растворами низкомол. веществ из-за свойств макромолекул: больших размеров, широкого диапазона гибкости (жесткости), большого набора конформаций, способности к конформац. перестройкам при изменении температуры, растворителя и т. п.
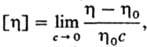
В разбавленных Р. п. гибкоцепные синтетич. макромолекулы принимают конформацию статистич. клубка, в объеме которого концентрация с0 собств. звеньев весьма мала (порядка 1% по массе и менее) и убывает с ростом мол. массы. Влияние мол. массы и геом. характеристик макромолекул на свойства Р. п. приводит к тому, что концентрация растворенного вещества не является однозначным критерием разделения Р. п. на разбавленные и концентрированные, в отличие от растворов низкомол. веществ. Р. п. со средней концентрацией с растворенного вещества считается разбавленным, если с < с0, т. е. среднее расстояние между макромолекулами значительно больше их размера. Условный показатель, характеризующий уд. объем, занимаемый макромолекулой,-характеристическая вязкость, где η и η0 — соотв. вязкость раствора с концентрацией с и вязкость чистого растворителя. Величина [η]-условный показатель, определяющий прирост вязкости растворителя при введении в него полимера. Если концентрация Р. п. выражена в г/л, то единица характеристич. вязкости-л/г или м3/кг. Р. п. является "разбавленным", если [η]c < 1. Разбавленные Р. п. используют для изучения характеристик индивидуальных макромолекул: мол. массы, размеров, конформаций, гибкости цепи и т. п. Интервал концентраций определяет т. наз. полуразбавленный Р. п.: концентрация полимера мала, но статистич. клубки перекрываются, проникая друг в друга. Клубковые конформации макромолекул сохраняются и в концентрированных Р. п., а также в свсрхконцентрированных Р. п., примером которых служат полимеры, пластифицированные труднолетучими растворителями (см. пластификация полимеров).
определяет т. наз. полуразбавленный Р. п.: концентрация полимера мала, но статистич. клубки перекрываются, проникая друг в друга. Клубковые конформации макромолекул сохраняются и в концентрированных Р. п., а также в свсрхконцентрированных Р. п., примером которых служат полимеры, пластифицированные труднолетучими растворителями (см. пластификация полимеров).
Др. особенность Р. п. — понижение совместимости компонентов из-за того, что энтропия смешения ΔSс снижается при соединении мономеров в единую цепь. Полное смешение полимеров с низкомол. растворителями возможно лишь в определенном интервале температур. Вне этого интервала взаимная растворимость компонентов становится ограниченной и происходит разделение Р. п. на две фазы, сосуществующие в равновесии.
На гипотетич. обобщенной диаграмме растворимости в координатах концентрация полимера с — температура T (рис. 1) имеется кривая (бинодаль), отделяющая замкнутую область температур и концентраций, внутри которой Р. п. расслаивается на две фазы. Максимум и минимум на бинодали определяют верхнюю и нижнюю критич. температуры смешения (соотв. ВКТС и НКТС) и критич. концентрации. В критич. точках составы сосуществующих фаз полимер — растворитель совпадают. При температурах вне интервала ВКТС-НКТС имеет место неограниченное взаимное смешение компонентов, причем ниже НКТС — за счет сильного взаимод. активных атомных групп полимера и растворителя, напр. за счет водородных связей. Вблизи критич. температуры перехода жидкость-пар (НКТС') также имеется область ограниченной совместимости.
Реальная полная диаграмма растворимости полимера с тремя критич. температурами до сих пор не получена. Наиб. часто проявляется на практике лишь ВКТС (хотя она может лежать выше точки кипения растворителя), а НКТС не достигается, чаще всего из-за высокой температуры замерзания растворителя. Имеются и системы, в которых существует лишь НКТС.
Форма и положение бинодали для данной пары полимер — растворитель зависит от мол. массы. С ростом мол. массы М полимера бинодаль смещается в сторону малых концентраций и больших температур, критич. концентрация скр ~ 1/М1/2, 1/Ткр линейно убывает с убыванием 1/М1/2 (пунктирная линия на рис. 1), т. е. растворимость полимера уменьшается. Такая зависимость используется для фракционирования полимеров по мол. массе. Предельное значение Ткр при М : со определяет т. наз. 9-температуру Флори (q-точку, q-усло-вие) как идеальную температуру, при которой клубкообразные макромолекулы в растворе имеют конформацию гауссова клубка, т. е. их средний квадратичный линейный размер R пропорционален М1/2, а с0 ~ 1/М1/2. С ростом температуры размеры макромолекулы в разб. растворах увеличиваются до R ~ М0,6, с0 ~ М−0,8 (растворитель "улучшается"). Предельная концентрация с0 убывает с ростом мол. массы полимера, а при данной мол. массе — с ростом температуры.
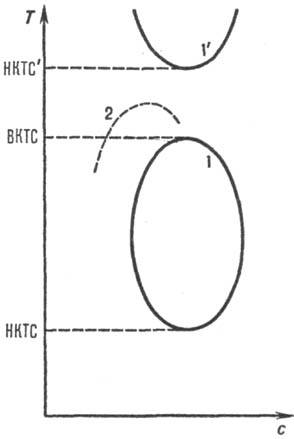
Рис. 1. Обобщенная диаграмма растворимости для системы аморфный полимер— растворитель. На осях отложены концентрация полимера с и температура Т. Кривые 1 и Г — бинодали, ВКТС, НКТС и НКТС' — соотв. верхняя и две нижние критич. температуры смешения; пунктирная кривая 2 показывает смещение бинодали 1 при увеличении мол. массы полимера.
Теория, позволяющая определить пределы совместимости полимера и растворителя в зависимости от мол. массы растворенного вещества и температуры, развита П. Дж. Флори и М. Хаггинсом в 40-х гг. 20 в. Энтропия смешения ΔSc системы полимер-растворитель рассчитывалась на основе решеточной модели (см. жидкость), согласно которой жидкость м. б. представлена квазирешеткой, в каждой ячейке которой может помещаться либо молекула растворителя, либо равный ей по размерам участок макромолекулы, что связано с конкретной конформацией цепи. Соответственно при расчете энтропии смешения ΔSc принимаются во внимание лишь допустимые кон-формации, а при малой молярной доле полимера в растворе возможны большие значения ΔSc. Наличие отличной от нуля теплоты смешения ΔHс обусловлено тем, что энергия межмол. взаимод. в чистых веществах-растворителе и полимере— отличается от энергии взаимод. растворитель-полимер. Избыточная своб. энергия взаимод., приходящаяся на одну молекулу растворителя в Р. п., характеризуется полуэмпирич. параметром Флори-Хаггинса c, который для данной пары полимер — растворитель является функцией температуры. С параметром X связан второй вириальный коэф. А2 разложения осмотич. давления раствора в ряд по концентрации, позволяющий оценить "качество" растворителя. Если контакты полимер — полимер и растворитель — растворитель энергетически менее выгодны, чем контакты полимер-растворитель, коэф. А2 > 0, растворитель считается хорошим. Растворители с А2 /i> 0 считаются плохими, растворимость полимера в них ограничена. При <i>А</i><sub>2</sub> = 0 растворитель <i style="color:green">наз.</i> квазиидеальным или q-растворителем, а температура, при которой положит. энтальпия смешения компенсируется возрастанием энтропии, является q-точкой. Для Р. п. q-точка аналогична точке Бойля для реальных газов <span style="color:green">(<i style="color:green">см.</i> <<вириальное уравнение).
Для жесткоцепных полимеров (напр., при длине жесткого сегмента 10 нм и выше) наблюдается ухудшение растворимости сравнительно с гибкоцепными полимерами, совместимость компонентов Р. п. часто достигается за счет сильных взаимод. полимер-растворитель. Растворимость полимера повышается при наличии у макромолекул подвижных боковых групп атомов. Растворы жесткоцепных полимеров изотропны лишь при концентрации ниже некоторой критической, при повышении концентрации на диаграмме растворимости наблюдается узкая область двухфазного состояния, а затем состояние полимерного жидкого кристалла (рис. 2). В изотропных Р. п. вязкость сильно возрастает с концентрацией, в жидких кристаллах макромолекулы ориентационно упорядочены, что обеспечивает уменьшение вязкости.
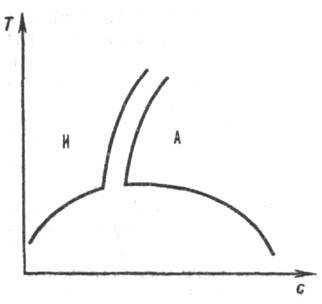
Рис. 2. Равновесная кривая сосуществования фаз в системе полимер — растворитель. По осям отложены концентрация полимера с и температура Т. Буквами И и А обозначены области существования изотропного и анизотропного растворов соответственно.
Биол. макромолекулы (белки, нуклеиновые кислоты) и их модели (полипептиды, полинуклеотиды) в растворах могут иметь специфич. конформации, стабилизированные внутри-мол. взаимодействием. Так, нативные глобулярные конформации белков в водном растворителе стабилизированы водородными связями и гидрофобными взаимодействиями неполярных групп атомов. Полярные группы на поверхности глобулы обеспечивают ее растворимость. При изменении состава и свойств растворителя, pH и ионной силы раствора или при изменении температуры происходят внутримол. конформац. переходы типа спираль-клубок и глобула-клубок, что приводит к резкому изменению всех свойств Р. п.
Лит.: Цветков В. Н., Эскин В. Е., Френкель С. Я., Структура макромолекул в растворах, М., 1964; Папков С. П., Равновесие фаз в системе полимер-растворитель, М., 1981; Жен П.-Ж., Идеи скейлинга в физике полимеров, пер. с франц., М., 1982.
Т. М. Бирштейн
Значения в других словарях
- Растворы полимеров — Термодинамически устойчивые однородные молекулярно-дисперсные смеси полимеров и низкомолекулярных жидкостей. В разбавленных Р. п. макромолекулы отделены друг от друга, и изучение свойств Р. Большая советская энциклопедия
