редкоземельные элементы
РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ
семейство из 17 хим. элементов III гр. периодической системы, включающее скандий, иттрий, лантан и лантаноиды: церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий и лютеций. Подразделяются на иттриевую (Y, La, Gd-Lu) и цериевую (Ce-Eu) подгруппы. Элементы Ce-Eu наз. легкими, a Cd-Lu-тяжелыми лантаноидами. Сам La иногда рассматривают отдельно от лантаноидов, а скандий — от РЗЭ. Устаревшее назв. лантаноидов Ln-лантаниды.
Электронная структура. Лантаноидное сжатие. Электронная конфигурация РЗЭ дана в табл. 1, у ионов М3+(М = Sc, Y, La) устойчивая конфигурация инертных газов. У Sc, Y и La в образовании хим. связи участвуют d- и s-электроны, у др. РЗЭ могут участвовать также f-электроны, однако близкие хим. свойства РЗЭ определяются гл. обр. внешними d- и s-электронами. Поэтому эти элементы объединены в одну группу.
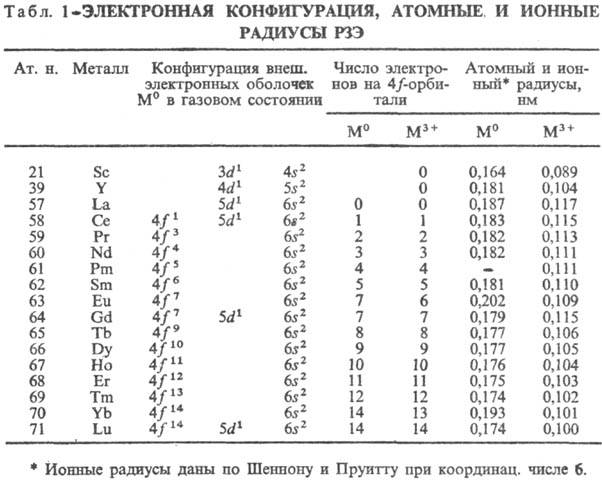
В состоянии М3+ РЗЭ имеют оболочку с 4f n-электронами (кроме Sc), в газовом состоянии-4f n+16s2 (кроме La, Ce, Gd и Lu, имеющих оболочку 4f n), в металлическом М°-4f n (для Eu и Yb-4f n + 1). Предполагается, что вакантная, заполненная наполовину и заполненная полностью f-оболочки обладают повыш. устойчивостью. Поэтому Sc, Y, La, Gd и Lu образуют только ионы М3+, для Ce и Tb устойчиво также состояние М4+, а для Eu и Yb-также М2+. Помимо электронной структуры на устойчивость валентных состояний РЗЭ влияют и др. факторы; напр., ионы Sm+, Tm+ (конфигурации f7 и f14), Pr5+ (f0), Dy5+ (f7) крайне неустойчивы.
У лантаноидов (как и у актиноидов) увеличение ат. н. приводит не к повышению, а к понижению размеров атомов и ионов. Причина этого явления, называемого лантаноидным сжатием,-неполное экранирование добавочными 4f-электронами уже имеющихся 4f-электронов. С ростом ат. н. РЗЭ увеличивается эффективный заряд ядра, воздействующий на каждый из f-электронов, а неполное экранирование последних вызывает смещение электронных оболочек атомов ближе к ядру. Это смещение не совсем регулярно, и наиб. выражено при добавлении электронов к f0 — и f7-оболочкам.
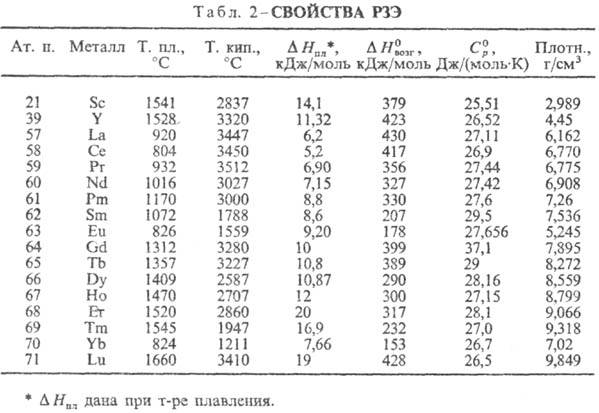
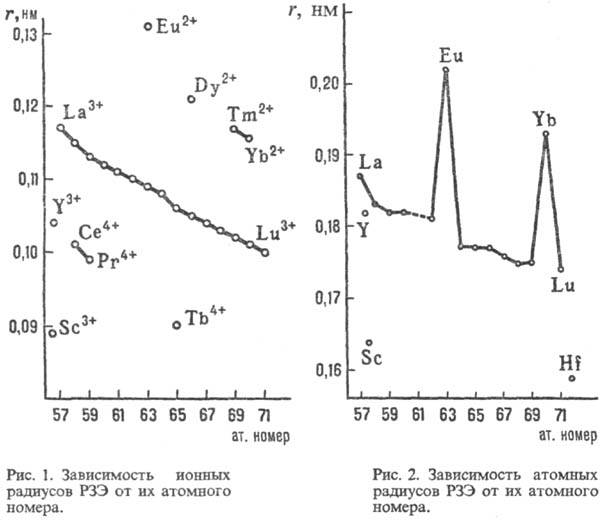
Свойства. РЗЭ — металлы серебристо-белого цвета, некоторые — с желтоватым оттенком (Pr, Nd). Они пластичны и электропроводны, легко поддаются мех. обработке. Мн. свойства простых веществ и соед. изменяются симбатно в рядах La-Eu и Gd-Yb. Относит, изменения свойств м. б. совсем небольшими или, наоборот, значительными. Особенно резко отличаются свойства, отражающие переход из связанного состояния в свободное и обратно. Например, при переходе из металлич. состояния в парообразное мерой является давление пара металлов. При 25 °C давления паров РЗЭ различаются более чем на 40 порядков, а при 1000 °C-примерно на 10 порядков (миним. давление характерно для La, Gd и Lu, макс. — для Eu и Yb). Это связано с большой разницей в энергии, необходимой для перехода 4/-электрона на 5d-уровень у М °. Об изменении др. свойств см. табл. 2. С др. стороны, есть свойства, остающиеся примерно постоянными для всех РЗЭ, напр. молярная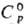 . Вследствие лантаноидного сжатия при переходе от La к Lu ионные радиусы РЗЭ и их атомные радиусы (кроме Eu и Yb) плавно уменьшаются (рис. 1, 2), плотность простых веществ увеличивается.
. Вследствие лантаноидного сжатия при переходе от La к Lu ионные радиусы РЗЭ и их атомные радиусы (кроме Eu и Yb) плавно уменьшаются (рис. 1, 2), плотность простых веществ увеличивается.
В хим. соед. РЗЭ проявляют степени окисления 3+ (все РЗЭ), 4+ (Ce, Рг, Nd, Tb, Dy) и 2+ (Sm, Eu, Tm и Yb). Ce — аналог Zr, Th и U(IV), Eu и Yb-аналоги щел.-зем. металлов. Со мн. электроотрицат. элементами (В, С, N, О, халькогены, галогены) РЗЭ образуют довольно стабильные соед.; высоко стабильны также гидриды РЗЭ. Поэтому РЗЭ — хорошие восстановители оксидов, сульфидов, галогенидов др. металлов.
На воздухе легкие лантаноиды окисляются при комнатной температуре, остальные — при нагр. до 180–200 °C; Ce и богатые Ce сплавы пирофорны. РЗЭ реагируют с водой (при нагр.-быстро), соляной, серной и азотной кислотами. РЗЭ образуют многочисл. интерметаллич. и комплексные соединения.
• см. также редкоземельных элементов галогениды, редкоземельных элементов оксиды
Распространенность в природе и природные источники. РЗЭ с четными ат. н. распространены заметно больше, чем РЗЭ с нечетными номерами (рис. 3). Иттрий и легкие лантаноиды (кроме Pm) содержатся в земной коре в больших количествах, чем тяжелые. Наиб. распространены Ce (4,61∙10−3% по массе), Y (2,81∙10−3%), Nd (2,39∙10−3%) и La (1,83∙10−3%), наименее-Tm (2,0∙10−5%), Lu (7,5∙10−5%) и Tb (9,1∙10−5%). Наиб. распространен в космосе Sc, затем Y, Ce, La, Nd, Gd и др. РЗЭ — прир. спутники Ti, Zr, Hf, Nb, Ta, Th, U и некоторых др. металлов. Известно большое количество минералов РЗЭ (по одним источникам, более 150, по другим — более 200), важнейшие из которых — бастнезит LnCO3F, монацит LnPO4, ксе-нотим LnPO4. Первые два содержат легкие лантаноиды, ксенотим — Y и тяжелые лантаноиды. Пром. значение имеют лопарит (Na,Ca,Ln)(Ti,Ta,Nb)O3, апатит Ca5(PO4)3F, эвксенит Ln(Nb, Та)TiO6∙хH2O, гадолинит (Fe2+,Be)3 ∙ Ln2Si2O10, перспективны алланит (Са, Fe2+)2 ∙ (Ln, Al, Fe3+)3 Si3O13Н, перовскит СаTiO3, сфен CaTiSiO4(O, OH, F), циркон ZrSiO4. РЗЭ содержатся в хвостах обогащения урановых руд (тяжелые лантаноиды и Y), во флюорите CaF2. Мн. минералы РЗЭ радиоактивны из-за наличия в них U, Th и продуктов их распада.
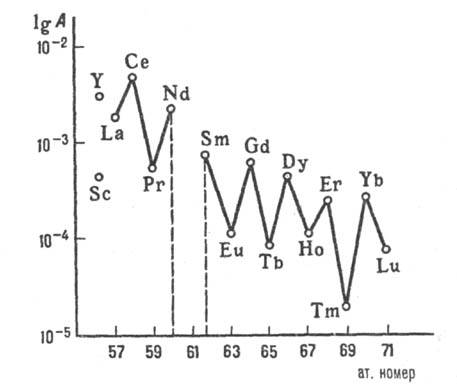
Рис. 3. Распределение РЗЭ в природе: A-содержание в земной коре, % по массе.
РЗЭ бастнезита состоят на 27–32% из La, 49–50% Ce, 4–5% Рг, 13–15% Nd, 0,5–1,0% Sm, 0,1–0,2% Eu и 0,3–0,4% Gd; общее содержание Ln2O3 73–76%. Месторождения бастнезита имеются в США, КНР, Бурунди и Швеции. Монацит содержит 42,3–66,9% Ln2O3 цериевой группы и 0,5–4,8% иттриевой группы; относит, количества: 19–23% La, 44–46% Ce, 5–6% Pr, 18–20% Nd, 4–5% Sm, 2–3% Y, 2% Gd и 1,5–2,0% др. РЗЭ, 5–10% ThO2. Монацит добывают в Бразилии, Индии, Австралии и Малайзии, он имеется также на Мадагаскаре, в Малави и др. Ксенотим содержит 51,9–62,6% Ln2O3 иттриевой группы, 0,3–4,6% цериевой группы и по ~ 3% U3O8 и ThO2. Добыча сосредоточена в Малайзии.
В СНГ важные источники РЗЭ-лопарит (30,7–34,1% Ln2O3 цериевой группы) и иттропаризит — сложный фторо-карбонат, ассоциированный с монацитом, ксенотимом, флюоцеритом и др. минералами. Общие пром. мировые запасы РЗЭ в виде оксидов, кроме Y, составляют (без СНГ) ок. 33 млн. т (1980).
Переработка руд и концентратов. Руды, содержащие минералы РЗЭ, обычно подвергают гравитац. обогащению для выделения тяжелых минералов-монацита, ксенотима, эвк-сенита и др. Монацит из смеси с др. минералами выделяют сочетанием гравитац. электромагнитного и электростатич. методов. Для индийского монацита применяют также флотацию. Обогащение калифорнийской бастнезитовой руды (7–10% оксидов РЗЭ) осуществляют флотацией, растворением CaCO3 в 10%-ной соляной кислоте, обжигом для удаления CO2 и перевода Ce3+ в Ce4+, доводя концентрацию оксидов РЗЭ до 85%.
Хим. переработка рудных концентратов включает выщелачивание, отделение радиоактивных примесей, выделение хим. концентратов РЗЭ (загрязненные оксиды, оксалаты, фториды, хлориды, сульфаты и др.), разделение самих РЗЭ и получение металлов. Для выщелачивания применяют кислоты или щелочь. Щелочную переработку монацита и ксенотима часто проводят в автоклавах при 140–150 °C с использованием 70%-ного раствора NaOH. Осажденные гидроксиды Th, U и РЗЭ раств. в соляной или азотной кислоте, частичной нейтрализацией раствора вновь осаждают гидроксиды Th и U, а полной нейтрализацией-гидроксиды РЗЭ. Раствор хлоридов РЗЭ после осаждения Th и U иногда выпаривают с выделением концентрата или направляют на разделение РЗЭ.
Кислотный способ предусматривает сульфатизацию монацита избытком конц. H2SO4 при 200–250 °C, выщелачивание растворимых сульфатов Th и РЗЭ водой, осаждение Th и послед. осаждение РЗЭ в виде комплексных солей действием Na2SO4 (осаждаются РЗЭ цериевой группы) или в виде оксалатов действием щавелевой кислоты. Комплексные сульфаты обрабатывают раствором NaOH, а затем раств. в соляной кислоте.
Бастнезитовые концентраты выщелачивают соляной кислотой, из нерастворимого остатка выделяют цериевый концентрат, а раствор используют для получения индивидуальных РЗЭ.
Апатитовые концентраты разлагают конц. HNO3, добавлением в раствор NaNO3 осаждают SiO2 и Na2SiF6, частичной нейтрализацией раствора аммиаком осаждают фосфаты РЗЭ.
Лопаритовые, бастнезитовые и эвксенитовые концентраты перерабатывают также хлорированием. Их брикетируют с коксом и обрабатывают Cl2 при 800–1200 °C. Нелетучие хлориды используют для получения мишметалла (сплава РЗЭ) или раств. в воде и направляют на разделение РЗЭ.
Разделение РЗЭ. Для разделения РЗЭ и очистки их от примесей применяют осадит. методы, селективное окисление или восстановление, ионообменную сорбцию и жидкостную экстракцию. Осадит. методы (выделение гидрокси-дов, оксалатов и др.) используют для очистки при получении концентратов РЗЭ, селективное окисление-для отделения Ce, реже — Pr и Tb, селективное восстановление-для отделения Ей (обычно в виде нерастворимого EuSO4), реже — Sm и Yb.
Осн. метод получения чистых РЗЭ в нач. 50-х гг.-ионообменная сорбция, с сер. 60-х гг. — экстракция. Сорбцию сначала использовали в периодич. варианте, а впоследствии для получения концентратов стали применять и непрерывные методы сорбционного разделения. Коэф. разделения соседних РЗЭ обычно не превышают 1,5–3,0.
Экстракц. методы более производительны и менее громоздки. Для разделения используют трибутилфосфат (коэф. разделения соседних РЗЭ 1,3–1,6 в HNO3), ди-(2-этилгексил)-фосфорную кислоту (коэф. разделения 1,6–3,2 в HCl), др. алкил-фосфаты. Перспективно применение карбоновых кислот и аминов. Используют экстракц. каскады с десятками ступеней разделения.
Получение металлов. Мишметалл получают электролизом расплава безводных хлоридов РЗЭ в присутствии хлоридов щелочных металлов при 800–900 °C в стальных аппаратах, стенки которых служат катодом, а графитовые стержни-анодом. Разработан электролиз смеси фторидов РЗЭ, расплавов соед. РЗЭ с жидким металлич. катодом (Zn, Cd), водных растворов с ртутным катодом. Индивидуальные РЗЭ получают металлотермич. восстановлением их фторидов (кроме Sm, Eu, Tm и Yb, которые производят восстановлением оксидов) или хлоридов. Восстановители-Са, реже Li или Mg, а также мишметалл, Na, Ce и др. РЗЭ. Металлы рафинируют вакуумной переплавкой.
Определение. При групповом определении осаждают оксалаты или гидроксиды РЗЭ, которые прокаливают при 900–1000 °C до оксидов. Оксиды Ce, Pr и Tb переводят в гемиоксиды действием H2 при 500–600 °C. Применяют также комплексонометрич. титрование растворами этилендиа-минтетрауксусной кислоты с ксиленоловым оранжевым или арсеназо. Индивидуальные РЗЭ определяют методами спектрофотометрия, пламенной и плазменной фотометрии, атомно-абсорбционным, масс-спектрометрическим, рентгенофлуоресцентным и активац. анализом.
Применение. Ок. 2/3 общего количества производимых РЗЭ и их соед. использует в виде смесей с прир. соотношением элементов или смесей, из которых удалены 1–2 элемента. Их применяют для получения катализаторов крекинга, в производстве легирующих добавок (мишметалл и силициды РЗЭ) к чугунам, сталям и цветным металлам, полирующих композиций, напр. для стекол. Смесь фторидов РЗЭ-добавки в угольные электроды. Значит. количество РЗЭ используют в виде концентратов. Так, добавки концентратов с СеO2 вводят в шихту для обесцвечивания оптич. стекол, концентраты La, Pr и Nd используют для получения бссцериевого мишметалла (для легирования цветных металлов), как добавку к ВаTiO3. Концентрат Рг и Nd (дидим) вводят в состав стекол для защиты глаз при сварке, для получения легирующих добавок к сплавам Mg. Концентрат с преимуществ. содержанием Pr применяют для окрашивания цирконовой керамики, Nd-для окрашивания стекол в фиолетовый цвет, Sm-для производства постоянных магнитов на основе SmCo5. Соед. RNi5 (R-мишметалл или La) перспективны как абсорбенты H2, катализаторы гидрирования, средства для очистки H2 и др., RFe2, сплавы R-Fe-B-перспективные магн. материалы.
Общее производство РЗЭ в 1980 составляло (без СССР) ок. 26 тыс. т, из них 11 тыс. т применялось в металлургии и производстве магнитов, 7 тыс. т — в виде катализаторов и химикатов, 8 тыс. т — в виде стекла и керамики.
Первым из РЗЭ открыт Y в 1794 Ю. Гадолином, открытие всех РЗЭ завершено к нач. 20 в. РЗЭ первоначально были выделены в виде оксидов, поэтому они и получили название "редких земель", т. к. химики прошлого наз. "землями" оксиды.
Лит.: Михайличенко А. И., Клименко М. А., в сб.: Итога науки — и техники. Металлургия цветных и редких металлов, т. 10, М., 1977, с. 5–36; Основы жидкостной экстракции, под ред. Г. А. Ягодина, М., 1981; Редкоземельные элементы, Технология и применение, под ред. Ф. Виллани, пер. с англ., М., 1985; Handbook on the physic and chemistry of rare earths, v. 1–12, ed. by K. A. Gscbeidner, Amst.-[a.o.], 1978–89; The rare earths in modern science and technology. Proceedings of the 15th rare earth research conference. Rolla (Mi), 15–18 June, 1981, N.N.-L., 1982; Forsberg J. H. [a.o.], Gmelin Handbook of Jnorganic Chemistry, 8 ed., pt D6, B.-[a.o.], 1983; Czack G. [a.o.], там же, pt C7. B.-[a.o.], 1983; Kubach I. [a.o.], там же, pt A7, В.-[а.о.], 1984; Birnbaum E., Forsberg J., там же, pt D4, B.-[a.o], 1986.
Г. А. Ягодин, Э. Г. Раков
Значения в других словарях
- Редкоземельные элементы — (РЗЭ; в минералогии — TR, от лат. terra rará) химические элементы побочной подгруппы III группы периодической системы Менделеева: скандий Sc (атомный номер Z = 21), иттрий Y (Z = 39), лантан La (Z = 57) и лантаноиды (14 элементов, Z от 58 до 71). Большая советская энциклопедия
- РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ — РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ, см. ЛАНТАНОИДЫ. Научно-технический словарь
- Редкоземельные элементы — (РЗЭ, TR — от лат. terra rara * a. rare-earth elements; н. Seltenerden, seltene Erden; ф. elements des terres rares; и. elementos de tierras raras) — хим. элементы 111 группы периодич. системы Mенделеева: Sc(ат. Горная энциклопедия
- РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ — РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ (редкоземельные металлы) — химические элементы побочной подгруппы III группы периодической системы: скандий, иттрий, лантан и лантаноиды. Большой энциклопедический словарь
