резонанса теория
РЕЗОНАНСА ТЕОРИЯ
теория электронного строения хим. соединений, в основе которой лежит представление о том, что электронное распределение, геометрия и все др. физ. и хим. свойства молекул должны быть описаны не одной возможной структурной формулой, а сочетанием (резонансом) всех альтернативных структур. Идея такого способа описания электронного строения принадлежит Л. Полингу (1928). Р. т. является развитием классич. теории хим. строения для молекул, ионов, радикалов, строение которых можно представить в виде неск. разл. структурных формул, отличающихся способом распределения электронных пар между атомными ядрами. Согласно Р. т., строение таких соед. является промежуточным между отдельными возможными классич. структурами, причем вклад каждой отдельной структуры можно учесть при помощи разл. модификаций квантовомех. метода валентных связей (см. валентных связей метод).
Для соед. с сопряженными связями из всех возможных структур с разл. типами спаривания электронов кратных связей достаточно рассмотреть лишь структуры с неперекрещивающимися связями (канонич. структуры). Электронное строение бензола описывается резонансом пяти канонич. структур:
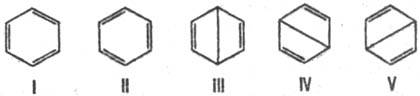
Волновая функция молекулы бензола по Полингу представляет линейную комбинацию:
Y = 0,624(YI + YII) + 0,271(YIII + YIV + YV).
Откуда следует, что осн. вклад (примерно 80%) в волновую функцию вносят кекулевские структуры I и II. Их эквивалентность и эквивалентность структур III-V объясняют вырав-ненность всех углерод-углеродных связей в молекуле бензола и их промежут. (примерно полуторный) характер между простой и двойной связями углерод-углерод. Это предсказание находится в полном соответствии с экспериментально найденными длиной связи C—C в бензоле (0,1397 нм) и свойствами симметрии его молекулы (группа симметрии D6h).
Р. т. с успехом применяют для описания строения и свойств ионов и радикалов. Так, строение карбонат-иона представляют как резонанс (обозначается двусторонней стрелкой) трех структур, каждая из которых вносит одинаковый вклад в волновую функцию:
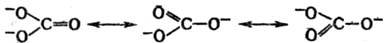
Поэтому ион обладает тригональной симметрией (группа симметрии V3h), и каждая связь C—O имеет на 1/3 характер двойной связи.
обладает тригональной симметрией (группа симметрии V3h), и каждая связь C—O имеет на 1/3 характер двойной связи.
Строение аллильного радикала не соответствует ни одной из классич. структур VI и VII и должно описываться их резонансом:
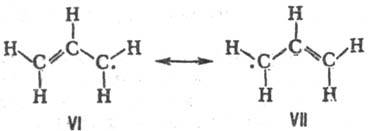
Спектр ЭПР аллильного радикала свидетельствует о том, что неспаренный электрон не локализован ни на одной из концевых метиленовых групп, а распределен между ними так, что радикал имеет группу симметрии C2h, причем энергетич. барьер вращения концевых метиленовых групп (63 кДж/моль) имеет промежут. значение между величинами, характерными для барьеров вращения вокруг простой и двойной связи C—C.
В соед., включающих связи между атомами с существенно разл. электроотрицательностями, значит. вклад в волновую функцию вносят резонансные структуры ионного типа. Строение CO2 в рамках Р. т. описывается резонансом трех структур:
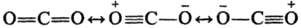
Длина связи между атомами С и О в этой молекуле меньше, чем длина двойной связи C=O.
Поляризация связей в молекуле формамида, приводящая к потере мн. свойств, характерных для карбонильной группы, объясняется резонансом:
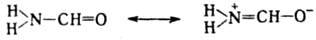
Резонанс структур ведет к стабилизации осн. состояния молекулы, иона или радикала. Мерой этой стабилизации служит энергия резонанса, которая тем больше, чем больше число возможных резонансных структур и чем больше число резонирующих низкоэнергетич. эквивалентных структур. Энергию резонанса можно рассчитать при помощи метода валентных связей или метода мол. орбиталей (см. молекулярных орбиталей методы) как разность энергий осн. состояния молекулы и ее изолир. связей или осн. состояния молекулы и структуры, моделирующей одну из устойчивых резонансных форм.
По своей осн. идее Р. т. очень близка к теории мезомерии (см. мезомерия), однако носит более количеств. характер, ее символика вытекает непосредственно из классич. структурной теории, а квантовомех. метод валентных связей служит прямым продолжением Р. т. В силу этого Р. т. продолжает сохранять определенное значение как удобная и наглядная система структурных представлений.
Лит.: Паулинг Л., Природа химической связи, пер. с англ., М.-Л., 1947; Уэланд Дж., Теория резонанса и ее применение в органической химии, пер. с англ., М., 1948; Полинг Л., "Ж. Весе. Хим. общества им. Д. И. Менделеева", 1962 т. 7, № 4, с. 462–67.
В. И. Минкин
Значения в других словарях
- Резонанса теория — (в химии) концепция, дополняющая постулаты классической теории химического строения и утверждающая, что если для данного соединения классическая теория (см. Большая советская энциклопедия
- РЕЗОНАНСА ТЕОРИЯ — РЕЗОНАНСА ТЕОРИЯ — в химии — концепция, дополняющая постулаты классической теории химического строения и утверждающая, что если для данного соединения классическая теория допускает построение нескольких приемлемых структурных формул... Большой энциклопедический словарь
