рн-метрия
рН-МЕТРИЯ
совокупность потенциометрич. методов определения водородного показателя pH. Они основаны на измерении эдс гальванич. элемента, состоящего из индикаторного электрода, обратимо реагирующего на изменение активности % ионов водорода, и электрода сравнения (насыщенного каломельного или хлорсеребряного). Последний обычно погружают в раствор электролита, который соединен с исследуемым раствором солевым мостиком-трубкой, заполненной насыщ. раствором KCl.
Индикаторным может служить водородный электрод, который представляет собой покрытую платиновой чернью платиновую пластинку, погруженную в раствор кислоты, насыщенный газообразным водородом. При парциальном давлении водорода рH2 = 1 атм (101,3 кПа) и активности ионов H3O+ aHзO+ = 1 потенциал этого электрода принят за нуль при любой температуре (стандартный водородный электрод). В соответствии с уравнением H+ + е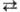 1/2H2 потенциал водородного электрода E=- 0,0591pH (В) при 25 °C. Водородный электрод пригоден для определения pH в интервале от 0 до 14. Для практич. работы он не удобен из-за относительно сложной конструкции, довольно быстрого отравления платины, необходимости получения электролитически чистого H2 и невозможности измерения pH в присутствии окислителей, восстановителей и ионов тяжелых металлов. Поэтому обычно применяют др. электроды, обратимые относительно ионов H+ ,-сурьмяный, хингидрон-ный и стеклянный, потенциалы которых отсчитывают от потенциала стандартного водородного электрода (водородная шкала потенциалов).
1/2H2 потенциал водородного электрода E=- 0,0591pH (В) при 25 °C. Водородный электрод пригоден для определения pH в интервале от 0 до 14. Для практич. работы он не удобен из-за относительно сложной конструкции, довольно быстрого отравления платины, необходимости получения электролитически чистого H2 и невозможности измерения pH в присутствии окислителей, восстановителей и ионов тяжелых металлов. Поэтому обычно применяют др. электроды, обратимые относительно ионов H+ ,-сурьмяный, хингидрон-ный и стеклянный, потенциалы которых отсчитывают от потенциала стандартного водородного электрода (водородная шкала потенциалов).
Сурьмяный электрод изготавливают из чистой метал-лич. Sb. Согласно уравнению Sb2O3 + 6H+ + 6е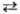 2Sb + ЗH2O, потенциал сурьмяного электрода Е = Е' + (RT/F)lnан+ , где Е'- экспериментально определяемая константа, R — газовая постоянная, Т — абс. температура, F- число Фарадея. Показания прибора с использованием этого электрода стабильны, погрешности измерений не превышают b0,2 pH в интервале pH 3–10; электрод пригоден для измерения pH в отсутствие окислителей, H2S и ионов тяжелых металлов; при этом необходимо контролировать температуру раствора.
2Sb + ЗH2O, потенциал сурьмяного электрода Е = Е' + (RT/F)lnан+ , где Е'- экспериментально определяемая константа, R — газовая постоянная, Т — абс. температура, F- число Фарадея. Показания прибора с использованием этого электрода стабильны, погрешности измерений не превышают b0,2 pH в интервале pH 3–10; электрод пригоден для измерения pH в отсутствие окислителей, H2S и ионов тяжелых металлов; при этом необходимо контролировать температуру раствора.
Х и н г и д р о н н ы й э л е к т р о д представляет собой гладкий платиновый электрод, погруженный в исследуемый раствор, насыщенный хингидроном — молекулярным комплексом 1:1 хинона (Q) и гидрохинона (H2Q). В соответствии с уравнением Q + 2H+ + 2е ⇄ H2Q потенциал электрода Е = E0Q/H2Q + (RT/2F)ln(aQa2H+/aH2Q). Так как (aQ/aH2Q) = 1, то E = = E0Q/H2Q + (RT/F)lnaH+ . Последнее уравнение справедливо в интервале pH 1–8; при pH > 8 отношение aQ/aH2Q не является постоянной величиной вследствие окисления хинона растворенным O2. Хингидронным электродом нельзя пользоваться в щелочной среде, в присутствии окислителей, восстановителей, аминов, NH3 и солей аммония. Достоинство этого электрода-низкое электрич. сопротивление, что позволяет применять для измерения pH простую электрич. схему (см. рис. в ст. потенциометрия).
Наиб. распространен стеклянный электрод, который представляет собой тонкостенный шарик из стекла спец. состава (напр., 72% SiO2, 8% CaO, 20% Na2O), припаянный к стеклянной трубке. Внутрь шарика наливают 0,1 М раствор HCl и погружают в него хлорсеребряный электрод (серебряная проволока в насыщ. растворе AgCl)- внутр. электрод сравнения. Чувствительной к ионам H+ является только стеклянная мембрана на кончике электрода, которую предварительно хорошо вымачивают в 0,1 М растворе HCl. Потенциал стеклянного электрода определяется уравнением Е = const + 0,0591 lgaH+ в широком интервале pH, протяженность которого зависит от сорта стекла. Состав стекла, применяемого для изготовления мембраны, влияет на величину константы равновесия (КH-M) обмена между ионами H+ в слое гидратированного геля на поверхности мембраны и ионами щелочных металлов в растворе. Большинство электродов не способны различать ионы H+ и ионы Na+, K+, Li+ при pH > 11, но есть электроды, дающие правильные результаты вплоть до pH 14. Недостаток стеклянного электрода-нестабильность во времени т. наз. потенциала асимметрии (входит в величину const), обусловленного неравноценностью внеш. и внутр. поверхности стеклянной мембраны. Поэтому необходимо периодически градуировать электрод по буферным растворам с известным pH (см. ниже). Потенциал стеклянного электрода устанавливается очень быстро, погрешность измерения pH в интервале 2–10 составляет b0,05 pH. Не мешают растворенные газы, окислители, восстановители, белки. Мешают дегидратирующие вещества, концент-рир. растворы щелочей и кислот. Неправильные результаты получаются в растворах с низкой буферной емкостью, напр. в воде. Стеклянный электрод пригоден для измерения pH не только растворов, но и эмульсий, суспензий, паст. В зависимости от назначения его размеры варьируют в широких пределах. Есть электроды, позволяющие измерять pH весьма малых объемов (~0,02 мл).
Стеклянный электрод обладает высоким электрич. сопротивлением (107–108 Ом), поэтому для измерения его потенциала необходим спец. прибор — pH-метр, который представляет собой электронный вольтметр с высоким входным сопротивлением или потенциометр с электронным усилителем (вместо гальванометра). В последнем случае усиленный на неск. порядков ток в цепи с исследуемым элементом можно детектировать грубым миллиамперметром.
Для измерения pH стеклянный электрод и электрод сравнения (каломельный) погружают сначала в буферный раствор с известным рHст (т. наз. pH-стандарт) и настраивают pH-метр на величину pH этого раствора. Затем электроды промывают и переносят в исследуемый раствор с pHx; при этом pHх = рHст + [(Еx — Eст)F/2,303RT], где Ех и Eст-соответ-ствующие потенциалы стеклянного электрода. Для удобства шкалу pH-метра градуируют в единицах pH и снабжают спец. устройством для контроля температуры раствора (чтобы регулировать величину 2,303RT).
Для градуирования стеклянного электрода в качестве pH-стандартов рекомендованы: насыщ. раствор тартрата К, 0,05 М раствор бифталата К, смесь 0,05 М раствора KH2PO4 и 0,025 М раствора Na2HPO4, смесь 0,008695 М раствора KH2PO3 и 0,03043 М раствора Na2HPO4, 0,01 М раствор Na2B4O7. При 25 °C величины pH этих растворов равны 3,56; 4,01; 6,87; 7,41; 9,18 соответственно. Причем pH будет иметь одно и то же значение независимо от того, какой из pH-стандартов был взят при градуировке электрода.
Хотя измеренные pH-метром значения pH равны — lgaHзO+ только для очень разбавленных водных растворов, тем не менее эти величины служат полезной характеристикой кислотности растворов, в т. ч. и неводных. При замене воды неводным растворителем увеличивается электрич. сопротивление раствора, становится менее воспроизводимым потенциал электрода, поэтому рекомендуется рассматривать каждый растворитель как независимую систему с собственной шкалой кислотности, протяженность которой определяется величиной константы автопротолиза растворителя.
рН-Метрию применяют для контроля разл. технол. процессов, в лаб. исследованиях и т. д.
Лит.: Бейтс Р., Определение pH. Теория и практика, пер. с англ., Л., 1968; Никольский Б. М., Матерова Е. А., Ионоселективные электроды, Л., 1980, с. 114; Мейтис Л., Введение в курс химического равновесия и кинетики, пер. с англ., М., 1984, с. 365.
Г. В. Прохорова
