селен
СЕЛЕН (от греч. selene — Луна; лат. Selenium) Se
хим. элемент VI гр. периодической системы, относится к халькогенам; ат. н. 34, ат. м. 78,96. Природный С. состоит из шести изотопов: 74Se (0,87%), 76Se (9,02%), 77Se (7,58%), 78Se (23,52%), 80Se (49,82%) и 82Se(9,19%). Поперечное сечение захвата тепловых нейтронов для прир. смеси 12,3∙10−28 м2. Конфигурация внеш. электронной оболочки атома 4s24р4; степени окисления −2, +4 и +6, редко +2; энергии ионизации при последоват. переходе от Se0 к Se6+ равны 9,752, 21,2, 32,0, 42,9, 68,3, 81,7 эВ; сродство к электрону 2,020 эВ; электроотрицательность по Полингу 2,40; атомный радиус 0,160 нм, ионные радиусы (нм, в скобках даны координац. числа) Se2− 0,184 (6), Se4+ 0,064 (6), Se6+ 0,042 (4), 0,056 (6).
Среднее содержание в Земной коре 1,4∙10−5% по массе, в воде морей и океанов 4∙10−3мг/л. Известно более 50 минералов С., напр. берцелианит Cu2Se, науманнит Ag2Se, самородный Se, халькоменит CuSeO3 ∙ 2 H2O. Содержание С. в пирите, галените, висмутине и др. сульфидах, а также в вулканич. сере до неск. %. Извлекают его в осн. из медных, пиритных, свинцовых, никелевых и др. руд, где он находится в рассеянном состоянии.
Свойства. При атм. давлении существует ряд модификаций С. Наиб. стабилен серый С. (γ-Se, "металлический" С.) с гексагон. кристаллической решеткой, а = 0,436388 нм, с = 0,495935 нм, z = 3, пространственная группа C312. Его получают из др. форм при их длит. нагревании, медленном охлаждении расплава, конденсацией паров и т. д. Структура серого Se состоит из параллельных спиральных цепей. Из растворов в CS2 получены три моноклинные модификации красного С.: α-Se — оранжево-красный, а = 0,9054 нм, b = 0,9083 нм, с = 1,1601 нм, β = 90,81 °, z = 32, пространственная группа P21/п, т. пл. 170 °C, плотн. 4,46 г/см3; β-Se-тем-но-красный, а = 1,285 нм, b = 0,807 нм, с = 0,931 нм, β = = 93,13°, z = 32, пространственная группа P21/а, т. пл. 180 °C, плотн. 4,50 г/см3; для красного γ-Se-a = 1,5018 нм, b = 1,4713 нм, с = 0,8789 нм, β = 93,61°, z = 64, пространственная группа P21/с, плотн. 4,33 г/см3. Эти три формы содержат кольцевые молекулы Se8 в форме короны.
Быстрым охлаждением расплава получают стекловидный черный С. — хрупкое вещество со стеклянным блеском от красно-коричневого до голубовато-черного цвета, плотн. 4,28 г/см3. Содержит в осн., как и жидкий С., плоские зигзагообразные цепочечные молекулы. Аморфный красный С. может быть получен, напр., восстановлением H2SeO3 на холоду. Это тонкий порошок, плотн. 4,26 г/см3, от ярко-красного до красновато-черного цвета. Имеет цепочечную структуру.
При давлении 27 МПа получена кубич. модификация С., а = 0,2982 нм. Моноклинный и аморфный С. при 1012 МПа образуют метастабильную гексагон. металлич. фазу.
Для серого γ-Se:т. пл. 221 °C, т. кип. 685 °C; плотн. 4,807 г/см3, плотн. жидкого 4,06 г/см3 (221 °C); 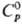 25,4 Дж/(моль∙К);
25,4 Дж/(моль∙К); 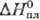 6,20 кДж/моль,29
6,20 кДж/моль,29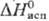 кДж/моль;
кДж/моль; 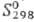 42,1 Дж/(моль∙К); уравнения температурной зависимости давления пара: над твердым С. lgp (гПа) = 13,7029–7644/T, над жидким lgp(гПа) = 8,2354–5011/T, теплопроводность 0,5 Вт/(м∙К); температурный коэф. линейного расширения 25,5∙10−6 К−1 (273 К); ρ8,0∙102 Ом∙м, температурный коэф. ρ0,6∙10−3 К−1 (298–398 К); полупроводник с дырочной проводимостью, ширина запрещенной зоны 1,8 эВ; диамагнитен, магн. восприимчивость — 0,469∙10−9. Для стекловидного С. ρ 1010 Ом∙м. Твердость по Моосу серого С. 2,0, по Бринеллю ~750 МПа, модуль нормальной упругости 10,2 ГПа. С. хрупок, выше 60 °C становится пластичным.
42,1 Дж/(моль∙К); уравнения температурной зависимости давления пара: над твердым С. lgp (гПа) = 13,7029–7644/T, над жидким lgp(гПа) = 8,2354–5011/T, теплопроводность 0,5 Вт/(м∙К); температурный коэф. линейного расширения 25,5∙10−6 К−1 (273 К); ρ8,0∙102 Ом∙м, температурный коэф. ρ0,6∙10−3 К−1 (298–398 К); полупроводник с дырочной проводимостью, ширина запрещенной зоны 1,8 эВ; диамагнитен, магн. восприимчивость — 0,469∙10−9. Для стекловидного С. ρ 1010 Ом∙м. Твердость по Моосу серого С. 2,0, по Бринеллю ~750 МПа, модуль нормальной упругости 10,2 ГПа. С. хрупок, выше 60 °C становится пластичным.
С., особенно аморфный и мелкодисперсный, активен химически. При нагр. на воздухе горит (цвет пламени-голубой) с образованием SeO2 (см. селена оксиды). С F2, C12 и Br2 реагирует при комнатной температуре. Сплавляется с I2, но иодиды при этом не образуются. Выше 200 °C реагирует с H2, давая H2Se. При нагр. образует соед. со всеми металлами (см. селениды). С водой реагирует при нагр.: 3Se + 3H2O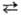 2H2Se + H2SeO3. Соляная и разб. серная кислоты с С. не взаимодействуют. В конц. H2SO4 С. раств. на холоду, давая зеленый раствор, содержащий полимерные катионы
2H2Se + H2SeO3. Соляная и разб. серная кислоты с С. не взаимодействуют. В конц. H2SO4 С. раств. на холоду, давая зеленый раствор, содержащий полимерные катионы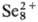 , который при хранении переходит в желтый раствор с катионами
, который при хранении переходит в желтый раствор с катионами 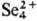 . В HNO3 при нагревании С. окисляется до H2SeO3, в конц. растворах щелочей раств. с образованием селенида и селената(IV), в присутствии O2 получаются красно-коричневые растворы, содержащие полиселениды вплоть до Na2Se4. С. раств. в растворах сульфидов и полисульфидов щелочных металлов с образованием тиоселенидов. При нагр. в растворе Na2SO3 или KCN образует соотв. Na2SSeO3 или KCNSe. Сильные окислители окисляют С. до Se(VI). С. реагирует с алюминиевым порошком в щелочной среде:
. В HNO3 при нагревании С. окисляется до H2SeO3, в конц. растворах щелочей раств. с образованием селенида и селената(IV), в присутствии O2 получаются красно-коричневые растворы, содержащие полиселениды вплоть до Na2Se4. С. раств. в растворах сульфидов и полисульфидов щелочных металлов с образованием тиоселенидов. При нагр. в растворе Na2SO3 или KCN образует соотв. Na2SSeO3 или KCNSe. Сильные окислители окисляют С. до Se(VI). С. реагирует с алюминиевым порошком в щелочной среде:
12Se + 2Al + 8NaOH → 3Na2Se4 + 2NaAlO2 + 4H2O
Гидрид С. (селеноводород) H2Se — бесцветный газ с неприятным запахом; т. кип. −41,35 °C, т. пл. −65,72 °C; плотн. жидкого 2,12 г/см3; в сухом воздухе при комнатной температуре устойчив, во влажном постепенно окисляется до Se; при нагр. на воздухе горит с образованием SeO2; мало раств. в воде (0,096 М при 15 °C), раствор имеет слабокислую реакцию; сильный восстановитель; получают из Se и H2 при ~500 °C; используют для получения С. высокой чистоты, селенидов и селенорганических соединений.
Гексафторид SeF6 — бесцветный газ; т. пл. −34,6 °C, т. возг. −46,6 °C; очень мало раств. в воде, не гидролизуется. Тетрафторид SeF4 — бесцветная жидкость; т. пл. −9,5 °C, т. кип. 101 °C; плотн. 2,75 г/см3; бурно реагирует с водой, разъедает стекло. Получают фториды фторированием С.
Тетрахлорид SeCl4 — бесцв. или светло-желтые кристаллы; т. пл. 305 °C, т. возг. 196 °C; плотн. 2,7 г/см3; водой гидролизуется, в конц. соляной кислоте образует гексахлоро-селенистую кислоту H2SeCl6; получают хлорированием С.; используют для получения чистого С. и его соединений, как хлорирующий агент. Диселендихлорид (монохлорид С.) Se2Cl2-маслянистая коричневая или темно-красная жидкость; т. пл. −85 °C, т. кип. 127 °C (с разл.); плотн. 2,77 г/см3; водой гидролизуется, этанолом и диэтиловым эфиром разлагается; получают взаимод. Se с SeCl4; про-межут. продукт в некоторых способах получения и очистки С., реагент для синтеза селенорг. соединений. Оксохлорид (селенилхлорид) SeOCl2-желтоватая жидкость; т. пл. 10,9 °C, т. кип. 179,6 °C; плотн. 2,445 г/см3; дымит во влажном воздухе, легко гидролизуется; смешивается с CCl4, CS2, CHCl3, бензолом; растворяет S, Se, I2, хлориды мн. металлов; получают взаимод. SeO2 с SeCl4 при: 200 °C; используют для получения чистого С., как хлорирующий агент, растворитель, пластификатор для полимеров.
Получение. Осн. источники С. — шламы сернокислотного производства (содержат своб. Se) и медеэлектролитные шламы (содержат селениды тяжелых металлов). При небольшом содержании С. в шламах первого типа их обогащают флотацией или экстракцией расплавл. S. Для извлечения С. шлам или концентрат выщелачивают раствором Na2S (из раствора С. осаждается при продувании воздуха) или Na2SO3 (с послед. действием H2SO4). Применяют также окислит. обжиг с улавливанием возгона водой и послед. осаждением С. действием NaHSO3 в соляной кислоте или окислит. спекание шлама с Na2CO3. После водного выщелачивания раствор подкисляется HCl, осадок TeO2 отфильтровывают, после чего С. осаждают действием FeSO4 [для восстановления Se(VI)] и SO2.
Из медеэлектролитных шламов сначала удаляют Cu обработкой разб. H2SO4 с продувкой воздухом, а затем проводят окислит. обжиг с отгонкой SeO2 или спекание с Na2CO3 в окислит. атмосфере с послед. водным выщелачиванием. Часто окисление ведут без предварит. удаления меди нагреванием с конц. H2SO4, после чего обжигом отгоняют SeO2. Его улавливают водой или содовым раствором и С. осаждают в кислой среде при действии SO2. Др. путь переработки селенистых растворов-восстановление металлич. А1 и осаждение С. продувкой воздухом. Для концентрирования селенсодержащих растворов применяют экстракцию, сорбцию на анионитах из слабощелочных или нейтральных растворов.
Из хим. методов рафинирования чаще других используют сульфитно-циклич. метод, основанный на обратимой реакции С. с раствором Na2SO3. Большинство др. хим. методов включает окисление С. (напр., сжиганием в O2), очистку полученного SeO2 возгонкой, фильтрацией паров, ионным обменом и т. д. и затем восстановление SeO2, напр. SO2 или H2. С. высокой чистоты получают также очисткой через летучие соед.-H2Se, SeOCl2 и др.
После хим. очистки С. переплавляют, расплав фильтруют через стеклоткань или активир. уголь, подвергают вакуумной дистилляции или ректификации в инертной атмосфере.
Определение. Качественно С. обнаруживают по появлению красного осадка или розового окрашивания при восстановлении его соед. действием Na2S2O5, NH2OH, Ph2N2H2 и др. до Se0, желтого окрашивания или коричнево-красного осадка с 3,3'-диаминобензидином, синего или зеленого окрашивания с пирокатехином, пирролом. Количественно С. определяют фотометрическими или флуорометрическими методами с 3,3'-диаминобензидином, о-фенилендиамином и др., а также измерением окраски коллоидных растворов С., полученных, напр., с N2H4. Используют титриметрич. (тиосульфатный и иодометрич.), полярографич., атомно-адсорбционный методы, редко-гравиметрический.
Применение. Аморфный С. входит в состав светочувствит. слоев в ксерографии. Серый С. — полупроводниковый материал (для диодов, фоторезисторов, мишеней видиконов и др.), пигмент для стекла, присадка к стали, добавка к сере при вулканизации, его используют для получения разл. катализаторов, гербицидов, инсектицидов, лек. препаратов, пигментов и т. д.
Мировое производство С. (без СССР) ок. 1700 т/год (1988). Соединения С. очень ядовиты; сам С. менее токсичен, но пары его ядовиты; ПДК аморфного С. в воздухе 2 мг/м3, SeO2, Na2SeO3 0,1 мг/м3, С. в воде 0,01 мг/л. Селен открыт Й. Берцелиусом в 1817.
Лит.: Бэгнал К., Химия селена, теллура и полония, М., 1971; Назарен-ко И. И., Ермаков А. Н., Аналитическая химия селена и теллура, М., 1971; Исакова Р. А., Резняков А. А., СпивакМ.М., Рафинирование селена, А.-А., 1975; Букетов E. А., Угорец М. 3., Гидрохимическое окисление халь-когенов и халькогенидов, А.-А., 1975; Федоров П. И., в кн.: Химия и технология редких и рассеянных элементов, под ред. К. А. Большакова, 2 изд., ч. 3, М., 1976, с. 92–158; Грейвер Т. Н., Зайцева И. Г., Косовер В. М., Селен и теллур. Новая технология получения в рафинирования, М., 1977; Есир-кегенов Г. М., Селен и теллур, А.-А., 1981.
П. И. Федоров
Значения в других словарях
- Селен — (Selenium) Se, химический элемент VI группы периодической системы Менделеева; атомный номер 34, атомная масса 78, 96; преимущественно неметалл (См. Неметаллы). Природный... Большая советская энциклопедия
- селен — -а, м. Химический элемент, серое кристаллическое вещество, полупроводник. [От греч. σελήνη — луна] Малый академический словарь
- селен — Селе́н/ (хим.). Морфемно-орфографический словарь
- селен — орф. селен, -а (хим.) Орфографический словарь Лопатина
- селен — СЕЛЕН (Selenium; от греч. selene — луна), Se, химич. элемент VI гр.периодич. системы Менделеева. Как микроэлемент содержится в почвах, растениях. При поступлении в организм животного в избыточном количестве С. вытесняет серу из мн. органич. соединений. Ветеринарный энциклопедический словарь
- селен — селен , -а Орфографический словарь. Одно Н или два?
- СЕЛЕН — СЕЛЕН (символ Se), серый металлоидный химический элемент VI группы периодической таблицы, открытый Йенсом БЕРЦЕЛИУСОМ в 1817 г. Получают, главным образом, как побочный продукт электролитической очистки меди. В химическом отношении селен похож на серу. Научно-технический словарь
- Селен — Se (от греч. selene — Луна, по аналогии c Теллуром * a. selenium; н. Selen; ф. selenium; и. selenio), — хим. элемент VI гр. периодич. системы Mенделеева, ат. н. 34, ат. м. 78, 96. Природный C. Горная энциклопедия
- Селен — (Selenium; Se) химический элемент VI группы периодической системы Д.И. Менделеева; атомный номер 34, атомная масса 78, 96; С. и все его соединения токсичны для человека. Медицинская энциклопедия
- селен — СЕЛЕН -а; м. [от греч. Selēnē — Луна] Химический элемент (Sе), серо-чёрное ядовитое вещество, полупроводник, обладающий фотоэлектрическими свойствами (применяется в технике и стекольной промышленности). ◁ Селеновый, -ая, -ое. С. фотоэлемент. С-ая кислота. С-ое стекло. Толковый словарь Кузнецова
- селен — СЕЛ’ЕН, селена, и селений, селеня, мн. нет, ·муж. (от ·греч. selene — луна) (·хим. ). Химический элемент, представляющий собой серо-черный металлоид, редко встречающийся в природе в чистом виде и добываемый гл. обр. при выработке серной кислоты. Толковый словарь Ушакова
- селен — СЕЛЕН, селений м. простое химическое начало, коего свойства ближе к сере, нежели к металлам. Селеновая кислота. Селенистая медь, содержащая селен. Селенит гипсовый шпат, ископаемое. Толковый словарь Даля
- селен — Селена, мн. нет, м. [от греч. selene – луна] (хим.). Химический элемент, представляющий собой серое кристаллическое вещество, электропроводность которого изменяется в зависимости от освещения; редко встречается в природе в чистом виде и добывается гл. обр. при выработке серной кислоты. Большой словарь иностранных слов
- СЕЛЕН — СЕЛЕН (лат. Selenium) — Se, химический элемент VI группы периодической системы Менделеева, атомный номер 34, атомная масса 78,96. Название от греческого selene — Луна. Образует несколько модификаций. Большой энциклопедический словарь
- селен — селен м. Химический элемент — серо-черный металлоид, применяемый при изготовлении фотоэлементов, а также в стекольной промышленности. Толковый словарь Ефремовой
- Селен — (хим.) Selen нем., Selemum франц. и англ.; при О = 16, Se = 79,1 — по Экману и Петтерсоону, что согласно с одним из старых определений Берцелиуса — элемент с характером неметалла; он принадлежит к группе кислорода и, по химическим отношениям... Энциклопедический словарь Брокгауза и Ефрона
