селенофен
СЕЛЕНОФЕН
мол. м. 131,03; т. пл. −38 °C, т. кип. 110,5–111 °C/753 мм рт. ст.; 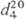 1,5358;
1,5358; 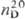 1,5715; давление пара (МПа) 6,3∙10−2 (25 °C), 1,49∙10−2 (50 °C), 4,75∙10−2 (85 °C); μ 1,327∙10−30 Кл∙м. Молекула плоская.
1,5715; давление пара (МПа) 6,3∙10−2 (25 °C), 1,49∙10−2 (50 °C), 4,75∙10−2 (85 °C); μ 1,327∙10−30 Кл∙м. Молекула плоская.

С. — ароматич. π-электронная система с электро-нодонорным гетероатомом. Мало чувствителен к действию кислот, щелочей, окислителей и восстанови телей; с изатином дает голубое окрашивание (индо-фениновая реакция); пикратов, иодметилатов не обра-зует.
С. легче, чем бензол, вступает в реакции электроф. (нитрование, сульфирование, галогенирование, ацилирование и др.) и нуклеоф. (металлирование) замещения. Реакции идут преим. в положение 2, послед. замещение-преим. в положение 5. С малеиновым ангидридом С. дает двойной аддукт с выделением Se. Под действием алкиллития раскрывает цикл.
Методы синтеза С. и его замещенных: взаимод. парафиновых, этиленовых, ацетиленовых или сопряженных диеновых углеводородов с Se, SeO2, H2Se или (CH3)2Se; замена гетеро-атома в пятичленных гетероциклах на атом Se, циклизация дикарбонильных соед. с P2Se5, напр.:
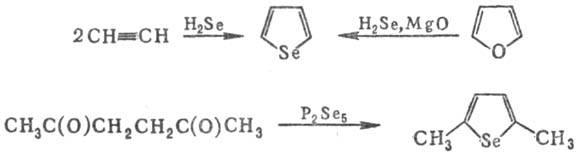
Производные С. — эффективные высокотемпературные ан-тиоксиданты, экстрагенты для выделения и разделения металлов (напр., Zr и Hi), физиологически активные соед. (аминоспирты), полимерные материалы (на основе тетра-замещенных производных С.).
Лит.: Общая органическая химия, пер. с англ., т. 8, М., 1985, с. 340–49; Magdesieva N. N., "Adv. Heterocycl. Chem.", 1970, v. 12, p. 1; Hornfeldt А.-В., "Adv. Heterocycl. Chem.", 1982, v. 30, p. 127–66. См. также лит. при ст. селенорганические соединения.
Н. Н. Магдесиева
