серы галогениды
СЕРЫ ГАЛОГЕНИДЫ
газы либо легколетучие жидкости с резким запахом (см. табл.). Все фториды, кроме серы гексафторида, легко гидролизуются водой и ее парами. Осн. метод их получения — взаимод. F2 с жидкой или парообразной S, реже — с суспензией или растворами S в инертных растворителях с послед. разделением смеси. Тетрафторид SF4 устойчив до 700 °C, выше 300 °C окисляется O2 до SOF4, в присутствии катализаторов с F2 дает SF6; раств. в жидком HF и бензоле; получают взаимод. F2 с хлоридами S в присутствии катализаторов, а также смеси Cl2 и HF с S или ее хлоридами. Дитиодекафторид S2F10 при нагр. разлагается до SF4 и SF6. Дитиодифторид S2F2 существует в виде двух изомеров: FSSF и SSF2; при нагр. разлагается до SF4 и S; получают взаимод. фторидов металлов с S или хлоридами S.
Хлоропентафторид SClF5 при 200–300 °C разлагается с выделением SF6 и Cl2; получают взаимод. хлоридов S с HF, гидрофторидами орг. оснований, реакцией SF4 с Cl2.
Дитиодихлорид C1SSC1: пром. продукт зеленовато-желтоватого цвета, бывает также желтого цвета (с примесью S) и красного (с примесью SCl2); ок. 137 °C разлагается на S и Cl2; водой гидролизуется до SO2, H2S, HCl, взаимод. которых приводит к образованию S и политионовых кислот; раств. до 66% по массе S, хорошо раств. в этаноле, бензоле, диэтиловом эфире, CS2; с оксидами и сульфидами мн. металлов образует хлориды и S, с сульфатами-SO2 Cl2, хлориды металлов, S, с SbCl3, HgCl2 и др. — аддукты; получают взаимод. S с Cl2 при 130 °C (очищают перегонкой), как побочный продукт при производстве CHCl3, промежут. продукт в производстве некоторых инсектицидов. S2Cl2- первый член ряда дихлорсульфанов 8nCl2 (n достигает 100), при n — 3–8 SnCl2-оранжевые маслянистые жидкости; 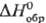 , кДж/моль: −51,9 (n = 3), −42,7 (4), −36,8 (5), −29,3 (6), -22, 2 (7), −14,7 (8); плотн., г/см3: 1,7441 (n = 3), 1,7774 (4), 1,8018 (5), 1,8219 (6), 1,84 (7), 1,85 (8); получают SnCl2 при нагр. S2Cl2 в токе H2 либо S2 Cl2 с H2 S и (или) H2 SB.
, кДж/моль: −51,9 (n = 3), −42,7 (4), −36,8 (5), −29,3 (6), -22, 2 (7), −14,7 (8); плотн., г/см3: 1,7441 (n = 3), 1,7774 (4), 1,8018 (5), 1,8219 (6), 1,84 (7), 1,85 (8); получают SnCl2 при нагр. S2Cl2 в токе H2 либо S2 Cl2 с H2 S и (или) H2 SB.
При действии Cl2 на S2C12 получают дихлорид SC12, а при дальнейшем хлорировании-тетрахлорид SC14 — бесцв. или бледно-желтые кристаллы при −35 °C, т. пл. −31 °C; ок. −15 °C разлагается; 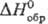 −56,1 кДж/моль; водой гидролизуется до SO2 и HCl.
−56,1 кДж/моль; водой гидролизуется до SO2 и HCl.
Дитиодибромид S2Br2 разлагается ок. 90 °C; 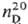 2,6288; получают при нагр. S с Br2; гидролизуется водой. Получены также малоустойчивые дибромсульфаны SnBr2.
2,6288; получают при нагр. S с Br2; гидролизуется водой. Получены также малоустойчивые дибромсульфаны SnBr2.
Применяют SF4 для селективного замещения карбонильного О на F2, для получения SF6; S2Cl2-вулканизующий агент, его используют для синтеза хлоридов, в производстве инсектицидов; S2C12 и SC12-применяют для хлорирования, в производстве добавок к высокоустойчивым смазочным маслам, 8Cl2-для получения SF4.
С г. токсичны, поражают слизистые оболочки, дыхат. пути; ПДК 0,5 мг/м3 (SF4, S2F10), 0,3 мг/м3 (S2Cl2) в воздухе рабочей зоны, 0,01 мг/м3 в атм. воздухе.
• см. также сульфурилгалогениды, тионилгалогениды
И. Н. Один
