силикаты
СИЛИКАТЫ
соли кремниевых кислот. Роль катионов в С. играют преим. элементы 2-го, 3-го и 4-го периодов периодич. системы. В природе широко представлены в виде минералов, входят в состав большинства горных пород, слагающих осн. часть земной коры (ок. 75% от ее общей массы), верхней и нижней мантии. Главнейшие минералы земной коры-полевошпатовые алюмосиликаты (55%, см. полевые шпаты), разл. классы орто-, мета- и диметасиликатов (15%), кварц (12%, см. кремния диоксид), слюды (3%). С. составляют минер. основу почв: кварцевый песок, первичные и метаморфизованные сланцы, глины и др. осадочные породы. Встречаются в лунном грунте — клинопироксеновые базальты, в никелисто-железистых каменных метеоритах-оливины, пироксены, плагиоклазы, кварц и др.
Атомы Si в кремнекислородных анионах м. б. изоморфно замещены (см. ниже) атомами Al, В, Be и др., в соответствии с чем различают алюмо-, боро-, берилло- и др. силикаты.
Кристаллохимическая систематика С. По хим. природе С. и в особенности С. сложного состава и строения (в т. ч. цементные гидросиликаты, цеолиты, С. с добавочными анионами и комплексными катионами) относятся к типичным гетеродесмич. соединениям, в которых реализуются одновременно разл. типы хим. связи-ионная, ковалентная, ионно-ковалентная, координационная, водородная и др. многоцентровые связи.
Структурная классификация С. базируется на рентгено-структурных расшифровках кристаллич. строения важнейших породообразующих силикатных минералов (преим. с мелкими катионами Be, Mg, Al, Zn, Fe, отчасти Na и К), выполненных начиная с кон. 20-х гг. У. Брэггом, Л. Полингом, Нараи Сабо. В основу структурной систематики С. (Брэгг, Ф. Махачки) было положено строение анионных группировок-способ сочленения между собой элементарных звеньев-правильных кремнекислородных тетраэдров 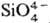 (рис. 1) в анионные радикалы конечных размеров или же в бесконечные одно-, двух- и трехмерные группировки. С 1950 в рентгеноструктурных исследованиях преим. школы Н. В. Белова были расшифрованы мн. кристаллич. структуры С. и их неорг. аналогов с крупными катионами Na, К, Ca, Ba, РЗЭ и др.
(рис. 1) в анионные радикалы конечных размеров или же в бесконечные одно-, двух- и трехмерные группировки. С 1950 в рентгеноструктурных исследованиях преим. школы Н. В. Белова были расшифрованы мн. кристаллич. структуры С. и их неорг. аналогов с крупными катионами Na, К, Ca, Ba, РЗЭ и др.
В основе систематики кремнекислородных группировок по Брэггу лежит размерное соответствие ребер тетраэдров SiO4 и октаэдров MgO6. По Белову для кристаллохимии С. характерно стерич. соответствие ребра октаэдра CaO6 с расстоянием между вершинами диорто-группы 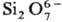 . Это наиб. наглядно иллюстрируется сочленением кремнекислородных цепочек с октаэдрич. колонками Са- и Mg-октаэдров в структурах пироксена энстатита Mg2(Si,O6)∞ (рис. 2, а) и пироксеноида волластонита Ca3 (Si3O9)∞ (рис. 2, б).
. Это наиб. наглядно иллюстрируется сочленением кремнекислородных цепочек с октаэдрич. колонками Са- и Mg-октаэдров в структурах пироксена энстатита Mg2(Si,O6)∞ (рис. 2, а) и пироксеноида волластонита Ca3 (Si3O9)∞ (рис. 2, б).
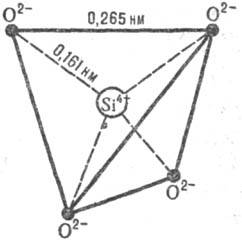
Рис. 1. Элементарный правильный кремне-кислородный тетраэдр SiO44−.
Для кристаллохимии С. по Белову определяющим критерием конструирования или формирования типа кристаллич. структуры С. и их неорг. аналогов явился принцип "приспособляемости" кремнекислородных анионных группировок к существенно более крупным полиэдрам катионов. При классификации С. выделяют элементарное звено, участвующее в построении кремнекислородного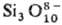 анионного каркаса,-орто-, диорто- и триортогруппы.
анионного каркаса,-орто-, диорто- и триортогруппы.
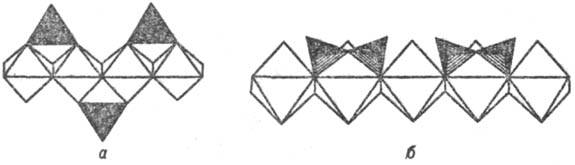
Рис. 2. Элементарные кремнекислородные единицы-ортогруппы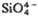 в структуре Mg-пироксена энстатите (а) и диортогруппы
в структуре Mg-пироксена энстатите (а) и диортогруппы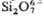 в Са-пироксеноиде волластоните (б).
в Са-пироксеноиде волластоните (б).
В целом С. могут быть додразделены на два класса: соединения с конечными размерами кремнекислородных группировок (островные структуры) и с бесконечными повторениями кремнекислородных тетраэдров при самых разл. способах их сочленения (полимерные, или конденсир., структуры). Причем анионный остов кристаллич. решетки, наряду с кремнекислородными анионами, может включать И дополнит. анионы-О2−, OH−, Cl−, F−, 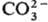 ,
, 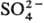 и некоторые др.
и некоторые др.
Островные С. делятся на соед. с одиночными кремнекислородными тетраэдрами — ортосиликаты (рис. 3, а) и со сдвоенными тетраэдрами — диортосиликаты (рис. 3, б). К таким С. относятся оливины (MgFe)2SiO4, циркон ZrSiO4, гранаты 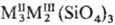 , где МII = Mg, Ca, Fe(II), Mn(II), МIII = Al, Fe(III), Cr(III), V(III) и др. Соед. со сдвоенными тетраэдрами-минералы группы тортвейтита Sc2Si2O7, ме-лилита и обширный класс пиросиликатов РЗЭ (рис. 3, б). По сравнению с орто- и диортосиликатами значительно менее распространены С. с открытыми линейными три- и тетраор-тогруппами, напр. киноит Cu2Ca2Si3O10∙2H2O.
, где МII = Mg, Ca, Fe(II), Mn(II), МIII = Al, Fe(III), Cr(III), V(III) и др. Соед. со сдвоенными тетраэдрами-минералы группы тортвейтита Sc2Si2O7, ме-лилита и обширный класс пиросиликатов РЗЭ (рис. 3, б). По сравнению с орто- и диортосиликатами значительно менее распространены С. с открытыми линейными три- и тетраор-тогруппами, напр. киноит Cu2Ca2Si3O10∙2H2O.
Среди природных и искусственных С. широко распространены соед. с циклич. (замкнутыми) кремнекислородными группировками из трех-, четырех-, шестизвенных (рис. 3, в, г, д) и более сложных (восьми-, девяти-, двенадцатичленных) колец. К данной группе островных метасиликатов относится, напр., псевдоволластонит α-Ca3Si3O9 (рис. 3, в). В берилле Ве3 Al2Si6O18 реализуется шестичленный кольцевой анион (рис. 3, д) с двумя мостиковыми Si—О—Si связями, приходящимися на каждый тетраэдр, как и в др. циклич. анионах.
Известны кристаллич. структуры островных С. со сдвоенными, конденсированными "двухэтажными" трех-, четырех- и шестизвенными кольцевыми анионами. Например, в минерале эканите ThK(Ca, Na)2Si8O20 реализуется сдвоенный четырехзвенный кольцевой анион. Аналогичный кремнекислородный анион обнаружен в С. с комплексными катионными группировками, напр. тетраметиламмониевыми в соед. [N(CH3)4]8Si8O20. Сдвоенное "двухэтажное" шестизвенное кольцо обнаружено, в родственном бериллу С. миларите K(Be2Al)Ca2Si12O30. В "двухэтажных" циклич. кремнекислородных группировках число мостиковых связей на каждый тетраэдр повышается соотв. до трех. Для мн. сложных по составу островных С. характерно сочетание в анионном остове одновременно неск. разл. кремнекислородных группировок, чаще всего орто- и диортогрупп.
Класс полимерных, или конденсированных, С. подразделяют на 4 подкласса. 1) Цепочечные С. с бесконечными цепочками из одиночных кремнекислородных тетраэдров, каждый из которых с соседними имеет по две мостиковые связи. Данный структурный тип метасиликатов охватывает большую группу породообразующих минералов и их синтетич. аналогов, моноклинных и ромбич. пироксенов и пиро-ксеноидов широкого диапазона составов: энстатит (MgFe)2 (Si2O6)∞, диопсид CaMg(Si2O6)∞, сподумен LiAl(Si2O6)∞, волластонит β-Ca3(Si3O9)∞, родонит CaMn4(Si5Oi5)∞ и мн. др. представители пироксен-пиро-ксеноидных С. (рис. 4) с периодом повторяемости из 2, 3, 5 кремнекислородных тетраэдров и более вдоль оси цепочки.
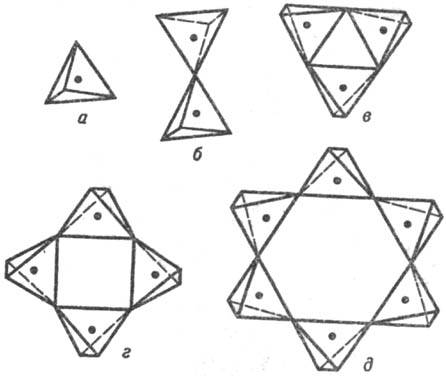
Рис. 3. Простейшие типы островных кремнекислородных анионных группировок: а — SiO4, б — Si2O7, в — Si3O9, г — Si4O12, д — Si6O18.
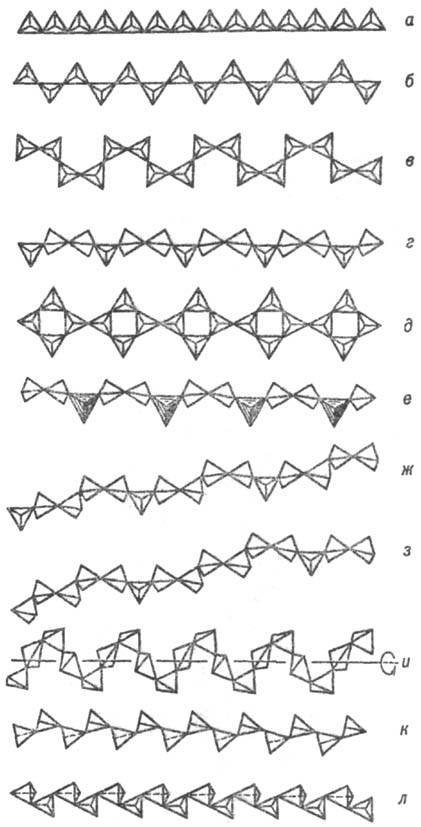
Рис. 4. Важнейшие типы кремнекислородных цепочечных анионных группировок (по Белову): а — метагерманатная, б — пироксеновая, в — батиситовая, г — волластонитовая, д — власовитовая, е — мелилитовая, ж — родонитовая, з — пирокс-мангитовая, и — метафосфатная, к — фторобериллатная, л — барилитовая.
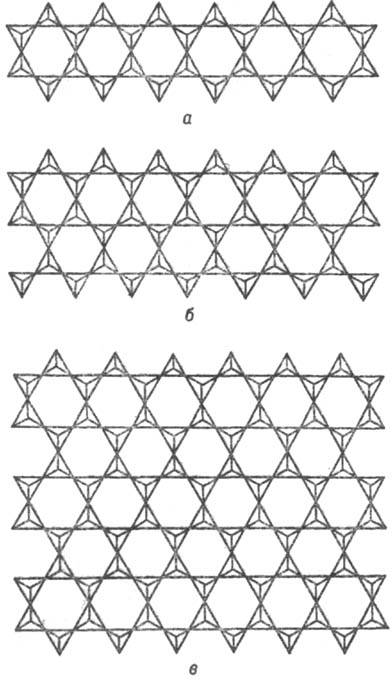
Рис. 5. Конденсация пироксеновых кремнекислородных анионов в ленточные двухрядные амфиболовые (а), трехрядные амфиболоподобные (б), слоистые тальковые и близкие им анионы (в).
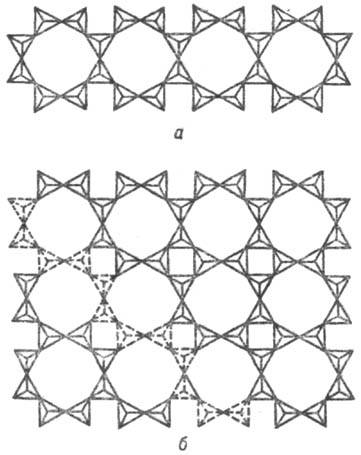
Рис. 6. Структурно-гомологический ряд кремнекислородных анионных группировок ксонотлита (а) и тоберморита (б); волластонит-см. рис. 4, г.
2) С. с ленточными кремнекислородными анионами из двух-, трех- и n-рядных цепочек, сконденсированных между собой по боковым связям перпендикулярно цепочке (рис. 5). В природе наиб. распространены в данном подклассе веществ амфиболовые и амфиболоподобные асбесты — волокнистые С. с двухрядными ленточными анионами, важнейшие представители — минералы тремолит Ca2Mg5(Si8O22XOH)2 и роговые обманки (Na,Ca)2(MgAl)5(Al,Si)8O22(OH)2. Ленточный анион цементного минерала ксонотлита Ca6(Si6O17)(OH)2 (рис. 6, а)-продукта конденсации волластонитовых цепочек (рис. 2,б или 4, г)-состоит из восьмичленных колец, в отличие от шестизвенных гексагон. колец амфиболовых лент (рис. 5, а, 6,7).
3) С. с двухмерными слоистыми или листовыми анионами характеризуются широким разнообразием возможных сочленений кремнекислородных тетраэдров в правильные или же в низкосимметричные шести-, четырех- и восьмичленные кольца с тетрагон. и ромбич. симметрией слоя, восьми-, шести- и четырехчленные кольца, воедино связанные в слоистом анионе, и т. д. (рис. 5, в, 6, б).
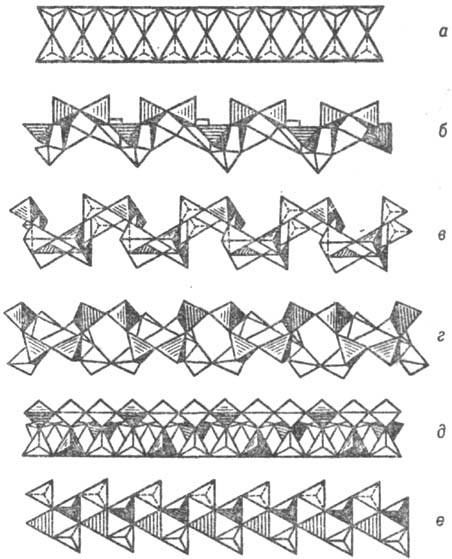
Рис. 7. Важнейшие типы ленточных кремнекислородных группировок (по Белову): а — силлиманитовая, амфиболовая-см. рис. 5, а, ксонотлитовая-см. рис. 6,а; б-эпидидимитовая; в — ортоклазовая; г — нарсарсукитовая; д — фенаки-товая призматическая; е-эвклазовая инкрустированная.
В прир. — слоистых С. группы слюд (мусковит 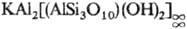 , биотит
, биотит тальк, пирофиллит и др.), глинистых
тальк, пирофиллит и др.), глинистых минералов [каолинита Al4(Si4O10)(OH)8 и др.] кремнекислородные сетчатые анионы образованы правильными шестичленными кольцами из тетраэдров SiO4. Эти сетки являются продуктом конденсации пироксеновых или же амфиболовых лент (рис. 5). Строение слоистых С. предопределяет их отчетливую спайность по базальной плоскости (параллельно слоям), наиб. отчетливо проявляющуюся в слюдах (рис. 8). При конденсации в плоскости волластонитовых цепочек (Si3O9)∞ (рис. 2,б или 4, г) или же ксонотлитовых лент (Si6O17)∞ (рис. 6, а) образуются тетрагон, тоберморитовые сетки Ca5(Si6O16)(OH)2∙4H20 (рис. 6, б).
минералов [каолинита Al4(Si4O10)(OH)8 и др.] кремнекислородные сетчатые анионы образованы правильными шестичленными кольцами из тетраэдров SiO4. Эти сетки являются продуктом конденсации пироксеновых или же амфиболовых лент (рис. 5). Строение слоистых С. предопределяет их отчетливую спайность по базальной плоскости (параллельно слоям), наиб. отчетливо проявляющуюся в слюдах (рис. 8). При конденсации в плоскости волластонитовых цепочек (Si3O9)∞ (рис. 2,б или 4, г) или же ксонотлитовых лент (Si6O17)∞ (рис. 6, а) образуются тетрагон, тоберморитовые сетки Ca5(Si6O16)(OH)2∙4H20 (рис. 6, б).
4) К С. каркасного строения относятся многочисл. группы алюмосиликатов (в меньшей степени — боросиликаты), вязаный каркас которых образован четырьмя мостиковыми связями и имеет общую формулу (AlmSin_mO2n)m−. Избыточный отрицат. заряд анионного остова из (Al,Si)-тетраэдров электростатически компенсируется щелочными и щел.-зсм. катионами, располагающимися в полостях каркасной структуры. Среди каркасных алюмосиликатов более всего в природе распространены щелочные полевошпатовые С.: твердые растворы альбита NaAlSi3O8 и ортоклаза KAlSi3O8, а также альбита и анортита CaAl2Si2O8, известные под назв. плагиоклазов. Каркасные С. цеолиты характеризуются большими внутр. полостями и входными окнами, в которых могут абсорбироваться крупные молекулы диаметром 0,3–0,5 нм и более (рис. 9).
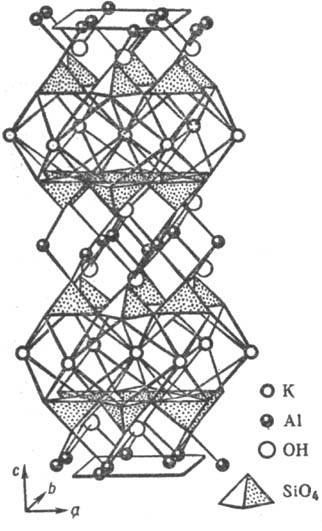
Рис. 8. Фрагмент (элементарный пакет) слоистой кристаллич. структуры мусковита KAl2(AlSi3O10XOH)2, иллюстрирующий переслаивание алюмокремне-кислородных сеток с полиэдрич. слоями крупных катионов Al и К.
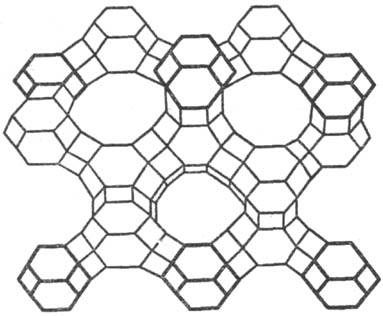
Рис. 9. Проекция фрагмента пористой кристаллич. структуры цеолита фошазита (фожазита) с широкими входными каналами эллиптич. сечения.
Изоморфизм в С. Подавляющее большинство природных С. и их искусств. аналогов образуют фазы переменного состава или твердые растворы с изо- и гетеровалентными замещениями. Наиболее распространенные схемы изоморфных замещений: Mg ⇄ Fe2+ в оливинах; Mg + Si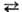 2Al(Fe3+), Ca + Mg
2Al(Fe3+), Ca + Mg Na + Al (Fe3+ ) в пироксеновой, амфиболовой и мн. др. группах веществ; 3 Mg
Na + Al (Fe3+ ) в пироксеновой, амфиболовой и мн. др. группах веществ; 3 Mg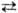 2 Al в слюдах; Na
2 Al в слюдах; Na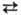 К, Na + Si ⇄ Ca + Al в полевошпатовой группе минералов и плагиоклазах.
К, Na + Si ⇄ Ca + Al в полевошпатовой группе минералов и плагиоклазах.
В природных С. распространены и значительно более сложные схемы электростатически скомпенсированных, т. наз. сопряженных, изо- и гетеровалентных изоморфных замещений одновременно в катионной и анионной подрешетках. Так, напр., в прир. и синтетич. слюдах (биотитах) реализуются сопряженные замещения:
3(Fe2+, Mg) 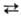 2A1, 4А1
2A1, 4А1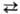 3Si, OH−
3Si, OH−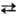 F−
F−
Направленными изоморфными замещениями удается кристаллохимически "закаливать" высокотемпературные формы С. при обычных условиях. Например, высокотемпературные гидравлически активные полиморфные модификации одной из осн. фаз цементного клинкера Ca2SiO4(γ, α' и α) стабилизируются в обычных условиях (замещением Ca стронцием или Ва).
В С. преим. полимерного строения (амфиболовых асбестах, слюдах и глинистых минералах) наряду с обычными изоморфными замещениями отдельных атомов широко развито образование фаз переменного состава, т. наз. структур когерентного срастания родственных макроатомных группировок по общим для них кристаллографич. направлениям. Подобного типа метастабильные фазы переменного состава, обнаруженные в полимерных С., могут рассматриваться как переходное состояние ввиду больших значений активац. барьера структурных перестроек.
Свойства. Природные С. и их синтетич. аналоги характеризуются, как правило, относительно высокой тугоплавкостью (1000–1300 °C, иногда до 2000 °C и выше), имеют высокие значения твердости (6–8 по шкале Мооса), достаточно устойчивы к выветриванию в атм. условиях, практически не раств. в воде (за исключением высокощелочных С.), инертны в растворах минеральных кислот и оснований (за исключением фтористоводородной кислоты).
С. и их важнейшие производные (алюмосиликаты) можно рассматривать как соли соотв. кремниевых и алюмокрем-ниевых кислот, которые в порядке повышения их кислотности м. б. расположены в ряд:
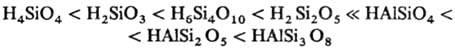
Поскольку кремниевые кислоты чрезвычайно слабые, они очень легко вытесняются из растворов своих солей: из "жидкого" стекла (Na, K)SiO3 др. кислотами, в т. ч. угольной.
Широкое изоморфное замещение в природных и технических С. кремния алюминием (и в значительно меньшей степени-бором) определяет выраженные кислотные свойства тетраэдрич. Al в алюмокремнекислородных анионных группировках всех структурных типов алюмосиликатов, в особенности каркасного строения.
Алюминий в октаэдрич. координации проявляет уже основные свойства и такие соед. наз., в отличие от алюмосиликатов, силикатами А1. Типичные представители данного класса веществ-силлиманит Al2O3∙SiO2=Al161Al[41SiO5 (ленточный алюмосиликат алюминия, в скобках указаны координац. числа А1) и его две разновидности-андалузит и кианит в обычных условиях не связаны между собой полиморфизмом. Катионногенные функции октаэдрич. А1 проявляются и в более сложных по составу и строению С. алюминия — в гранатах, бериллах, кордиеритах, минералах галените, топазе и др.
Октаэдрич. координация Si в С. — нетипичный случай. Так, при высоких и сверхвысоких давлениях получены сложные по составу и строению С. одновременно с тетраэдрич. и октаэдрич. координациями Si: щелочные тетрасиликаты 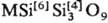 , где М = К, Rb, с вадеитовой структурой и бенитоитоподобный тетрасиликат бария
, где М = К, Rb, с вадеитовой структурой и бенитоитоподобный тетрасиликат бария 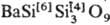
Образование С. в природе. В зависимости от внешних (давление, температура) и физ.-хим. условий прир. минералообразо-вания индивидуальные С. и горные породы на их основе классифицируют по генезису на: магматич. (изверженные) породы-полевые шпаты, плагиоклазы, нефелин, кварц, темноцветные железомагнезиальные минералы — оливины, пироксены, амфиболы, слюды и др.; метаморфич. породы-гранаты, сланцы, группа силлиманит-андалузит-кианитовых, берилл-кордиеритовых и др. минералов; осадочные породы-опалы, глинистые минералы, первичные сланцы и др.
Температура, давление, среда (состав парогазовой фазы, концентрация растворенных веществ, pH гидротермальных растворов и др. параметры) в каждом отдельном случае определяют последовательность кристаллизации и свойства С. Так, при магматич. процессе закономерности кристаллизации флюидно-силикатных расплавов описываются т. наз. реакц. вилкой (схемой) Боуэна (1928): первичным продуктом выделения является наиб. тугоплавкий высокоосновный С. — оливин (Mg, Fe)2SiO4, в последующем из расплава кристаллизуются мета- и диметасиликаты цепочечного (пироксены), ленточного (амфиболы) и слоистого (слюды) строения; отношение O/Si в хим. формуле С. изменяется от 4 до 2,5. Заканчивается кристаллизация, как правило, наиб. кислыми соед. — кремнеземом (кварцем), O/Si = 2, и его каркасными производными из группы плагиоклазовых и щелочных полевошпатовых алюмосиликатов.
С. — драгоценные и поделочные камни. Природные С. и многие их искусств. аналоги применяют в ювелирном деле. Наиб. дорогими ювелирными камнями являются сложные по составу и строению С. и среди них минерал берилл с его ценнейшими окрашенными разновидностями-темно-зеленым изумрудом (с изоморфными примесями Cr, Fe и V) и небесно-голубыми аквамаринами, тональность окраски которых зависит от соотношения изоморфной примеси Fe(III)/Fe(II).
Большим разнообразием окрасок отличаются гранаты, среди них выделяется минерал пироп огненно-красного цвета с легким фиолетовым оттенком благодаря изоморфной примеси Fe(II). Ювелирное значение имеют и высокопрочный (твердость по шкале Мооса 8) фторогидросиликат алюминия-топаз Al2 (SiO4XOH,F), сложный по составу боро-силикат-турмалин Na(Mg,Fe2+)3Al6(Si6O18)(BO3)3(OH,F)4. Турмалины обладают одновременно пиро- и пьезоэлектрич. свойствами. К ювелирным камням относятся золотисто-зеленый минерал хризолит из группы железистых оливинов, минерал циркон, содержащий, как правило, незначит. примеси РЗЭ и актиноидов. С. оливиновой и цирконовой групп, активированные РЗЭ, обладают и люминесцентными свойствами.
Среди поделочных ювелирных камней популярны полимерные С.: пироксен жадеит NaAlSi2 O6 оливкового маслянисто-зеленого цвета, а также близкий ему по цвету и свойствам нефрит (высокопрочная скрытокристаллич. разновидность волокнистого железосодержащего амфибола тремолита). Из группы пироксеноидных С. минерал родонит отличается большим разнообразием алых, малиновых и розовых окрасок с прожилками мягких оттенков в зависимости от изоморфных примесей. Используют родонит, как правило, для изготовления крупных декоративных предметов.
Применение и технология. Силикатные материалы -цементы, керамика, стекло (см. стекло неорганическое), глазури, эмали, ситаллы, изделия каменного литья, строит. (бетоны) и конструкц. материалы-имеют исключит. значение по масштабам использования в технике и народном хозяйстве. Природные С. — сырье в производстве Li, A1, Be, Cs, Zr, Hf, соды, поташа и т. д. С. щелочных металлов (см. натрия силикаты) используют в производстве силикатного клея, красок, замазок, в мыловарении.
В крупнотоннажном производстве (цемент, строит. керамика, стекло, огнеупоры) чаще всего применяют керамич., или обжиговый, способ синтеза-спекание прир. минер. сырья (кварцевого песка, глины, сланцев, талька и пр.) с карбонатами и, значительно реже, с сульфатами. Большой объем производства приходится на использование металлургич. шлаков (получение цементов и изделий каменного литья, шлакоси-таллов).
При получении силикатных материалов спец. назначения, напр. энстатитовой электро- и цельзиановой радиокерамики, люминофоров и пр., в качестве исходных компонентов чаще применяют оксиды или же высокосортное минер. сырье. Реже в технологии силикатных материалов используют метод соосаждения из растворов. Кристаллизацией из расплавов получают фторслюды, фторамфиболы и монокристаллы, многие технические С., в т. ч. и ювелирного назначения.
Гидротермальный способ в пром. масштабах используют в технологии кальций-силикатного белого кирпича автоклавного твердения (силикальцита), для выращивания крупных монокристаллов кварца, гидроксиламфиболов, цеолитов, ювелирных камней (изумруда и др.).
Многие природные и искусственные высокодисперсные С. (бентонитовые глины, амфиболы, цеолиты) используют как адсорбенты и материалы с ионообменными свойствами. Среди материалов радиоэлектроники наиб. применение находят монокристаллы ортосиликата эвлитина Bi4(SiO4)3, в особенности силикосилленита Bi12SiO20 и их германатные аналоги, обладающие пьезоэлектрич. и электрооптич. свойствами.
Лит.: Брэгг У., Кларингбулл Г., Кристаллическая структура минералов, пер. с англ., М., 1967; Минералы. Справочник, т. 3, в. 1–2, М., 1972–81; Белов Н. В., Очерки по структурной минералогии, М., 1976; Смит Г., Драгоценные камни, пер. с англ., М., 1980; Диаграммы состояния систем тугоплавких оксидов. Справочник, под ред. Ф.Я. Галахова, в. 5, ч. 1–4, Л., 1985–88; Пущаровский Д. Ю., Структурная минералогия силикатов и их синтетических аналогов, М., 1986; Горшков B.C., Савельев В.Г., Федоров Н.Ф., Физическая химия силикатов и других тугоплавких соединений, М., 1988; Либау Ф., Структурная химия силикатов, пер. с англ., М., 1988.
Р. Г. Гребенщиков
Значения в других словарях
- Силикаты — Природные (от лат. silex — кремень), класс наиболее распространённых минералов; природные химические соединения с комплексным кремнекислородным радикалом. Большая советская энциклопедия
- силикаты — -ов, мн. (ед. силикат, -а, м.). 1. Общее название минералов, в состав которых входит кремнезем. Природные силикаты. Химия силикатов. 2. Общее название многих строительных и промышленных материалов (стекла, керамики, огнеупоров, цемента, бетона, кирпича и т. д.). [От лат. silex, silicis — кремень] Малый академический словарь
- силикаты — орф. силикаты, -ов, ед. -кат, -а Орфографический словарь Лопатина
- СИЛИКАТЫ — СИЛИКАТЫ (природные), важнейший класс породообразующих минералов, состоящих из соединений кремния и кислорода (SiO4), с различным металлам. Научно-технический словарь
- силикаты — СИЛИКАТЫ -ов; мн. (ед. силикат, -а; м.). [от лат. silex (silicis) — кремень] 1. Минералы и синтетические химические соединения, представляющие собой соли кремниевой кислоты. Природные с. Химия силикатов. Толковый словарь Кузнецова
- силикаты — СИЛИКАТЫ, ов, ед. силикат, а, м. (спец.). Минералы, составляющие основную массу земной коры; промышленные материалы для изготовления цемента, стекла, огнеупоров, кирпича, керамики. | прил. силикатный, ая, ое. С. кирпич. Силикатные краски. Толковый словарь Ожегова
- СИЛИКАТЫ — СИЛИКАТЫ — соли кремниевых кислот. Примеры — каолинит Al4(Si4O10)(OH)8, топаз Al2(SiO4)F2. Многие важные промышленные материалы — керамика, кирпич, цемент, бетон, огнеупоры, стекло — в основном состоят из силикатов. Большой энциклопедический словарь
- силикаты — силикаты мн. 1. Минералы и синтетические химические соединения, представляющие по составу соли кремниевых кислот. 2. Общее название изделий из таких минералов (стекло, фарфор, цемент, кирпич и т.п.). Толковый словарь Ефремовой
- Силикаты — (хим.) — см. Кремний. Энциклопедический словарь Брокгауза и Ефрона
