скорость реакции
СКОРОСТЬ РЕАКЦИИ
скорость хим. превращения исходных веществ в продукты реакции. В случае гомог. элементарной реакции vAA + vBB → vVV + vZZ, где VA, VB, vV и VZ-сте-хиометрич. коэф. реагентов А и В и продуктов V и Z соотв., в замкнутом постоянном объеме V реагент А исчезает со скоростью uА = — d[А]/dt(t-время), а продукт Z появляется со скоростью uZ = d[Z]/dt. С.р. определяется выражением:
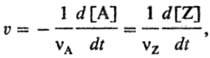
т. е. не зависит от того, по какому реагенту или продукту ее измеряют. Если в ходе реакции изменяется объем V системы, v измеряют по изменению концентрации одного из веществ:
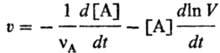
При постоянном объеме за протеканием реакции можно следить, измеряя число молей nА прореагировавшего вещества и определяя глубину протыкания реакции Δx = ΔnА/vА; в этом случае
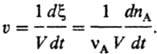
Для сложной реакции (т. е. состоящей из ряда отдельно не наблюдаемых элементарных стадий) описание С. р. исходит из непосредственно определяемых хим. анализом или к.-л. другим способом изменений количеств веществ. Наиб. просто С. р., протекающей стационарно, определяют в проточном безградиентном реакторе, в котором концентрации веществ и температура одинаковы по всему реакц. пространству (напр., благодаря перемешиванию или рециркуляции). В указанных условиях С. р. по веществу Вm (m-номер вещества) определяется выражением uBm = nBm/tV, где nBm-число молей вещества Вm, образовавшегося за время г в реакц. объеме V, если реакция гомогенна, или на поверхности площадью φ, если она гетерогенна (если Вm- исходное вещество, nBm < 0). В общем случае С. р. uBm различна в разных участках пространства и изменяется со временем, для ее определения пользуются соотношением:
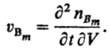
Скорости образования (расходования) всех веществ, участвующих в реакции, взаимосвязаны. Если реакция описывается одним хим. уравнением 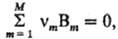 которое представляет собой выражение закона сохранения вещества (М-общее число реагентов и продуктов), С. р. по каждому веществу uBm пропорциональна его стехиометрич. коэф. vm (положительному для исходных веществ):
которое представляет собой выражение закона сохранения вещества (М-общее число реагентов и продуктов), С. р. по каждому веществу uBm пропорциональна его стехиометрич. коэф. vm (положительному для исходных веществ):
uBm=vmu
Одинаковое для всех участвующих в реакции веществ отношение uBm/vm=u есть, по определению, С. р.
Если стехиометрия реакции описывается неск. хим. уравнениями, которые линейно независимы, т. е. любое др. хим. уравнение является их линейной комбинацией, эти уравнения полностью задают стехиометрию реакции, их можно считать базисными. Число Q базисных уравнений связано с числом М всех веществ в системе и числом с независимых компонентов, изменения масс которых выражают все возможные изменения в составе системы (см. многокомпонентные системы) соотношением:
Q = М — с.
Природой реакции однозначно определено только число Q базисных уравнений, выбор их м. б. сделан по-разному (Q следует отличать от числа P базисных маршрутов сложной реакции-понятия, относящегося к механизму, а не к стехиометрии реакции; всегда P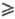 Q). Пусть реакция описывается Q базисными хим. уравнениями где
Q). Пусть реакция описывается Q базисными хим. уравнениями где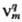 -стехиометрич. коэффициент вещества Вm в
-стехиометрич. коэффициент вещества Вm в 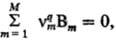 уравнении номер q (положит., отрицат. или равный нулю).
уравнении номер q (положит., отрицат. или равный нулю).
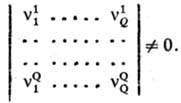
С. р. может быть охарактеризована скоростями образования т. наз. ключевых веществ B1, B2, ..., BQ, для которых определитель, составленный из соответствующих стехиометрич. коэф., отличен от нуля:
Скорости образования всех веществ, участвующих в реакции,-линейные функции стехиометрич. коэффициентов 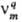 :
:
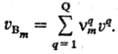
Зная uq, посредством этой системы уравнений получаем скорости образования остальных (М — Q) веществ. Величины u(q) естественно считать С. р. по соответствующим хим. уравнениям. Но следует при этом учитывать, что они имеют определенное значение лишь применительно ко всей данной совокупности базисных хим. уравнений реакции.
Для практич. целей скорости образования веществ при гетерог. катализе обычно относят не к единице поверхности катализатора, а к массе или к объему слоя каталитич. зерен.
Приведенные определения отвечают общепринятому в хим. кинетике пониманию С. р. как интенсивной величины. Иногда, по преимуществу в литературе по хим. термодинамике, используют предложенное де Донде определение С.р., согласно которому она служит экстенсивной величиной. Для реакции, описываемой одним хим. уравнением, С. р.
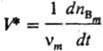
Экстенсивную величину V* удобнее называть производительностью (реактора, зерна катализатора, в зависимости от рассматриваемой зоны реакции). Тогда С. р. v — плотность производительности или, в случае гетерог. реакции, поверхностная плотность производительности.
М. И. Темкин
Значения в других словарях
- СКОРОСТЬ РЕАКЦИИ — СКОРОСТЬ РЕАКЦИИ, в химии — скорость протекания ХИМИЧЕСКИХ РЕАКЦИЙ до их завершения или до состояния химического РАВНОВЕСИЯ. Скорость увеличивается при наличии одного или нескольких факторов — присутствия КАТАЛИЗАТОРА или активатора, нагревания... Научно-технический словарь
- Скорость реакции — См. Химические реакции. Энциклопедический словарь Брокгауза и Ефрона
