сопряжение связей
СОПРЯЖЕНИЕ СВЯЗЕЙ (конъюгация связей)
чередование простых и кратных связей в структурной формуле соед. (напр., в 1,3-бутадиене CH2=СН—CH=CH2). В широком смысле понятие С. с. охватывает также гомосопряжение (в альтернирующую последовательность простых и двойных связей включается один или большее число sp3-гибридизованных атомов, напр. соед. формулы I), спиросопряжение (в ненасыщ. спирановых структурах, напр. II), сверхсопряжение (гиперконъюгация)-сопряжение кратных (или группы простых) связей с группой σ-связей одного атомного центра; III, IV.
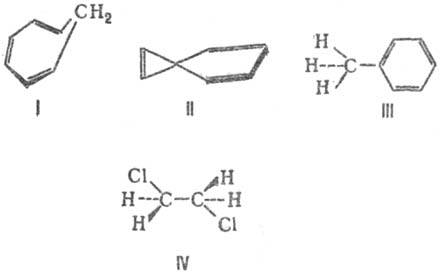
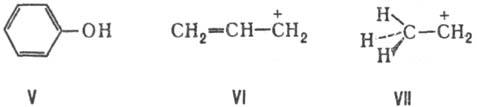
Расширение толкования С. с. связано также с представлениями о сопряжении не только неск. связей, но и кратных (или простых) связей с любым атомным центром-как обладающим одним электроном или неподеленной электронной парой (С−, О, NR2 и др., напр. V), так и центром с вакантной орбиталью (С+ , В, А1 и др., напр. VI и VII). Структурная единица, содержащая сопряженные связи, наз. сопряженной системой.
Квантовая химия рассматривает С. с. как взаимод. между орбиталями отдельных фрагментов молекулы, которое может осуществляться по тому или иному механизму. Например, σ-сопряжению соответствует взаимод. орбиталей простых связей, π-сопряжению — взаимод. орбиталей кратных связей. σ-C. с. всегда присутствует в любой молекуле, состоящей из трех или большего числа атомов. В то же время наблюдаемые свойства полиенов и аннуленов описываются исходя из представлений как σ-, так и π-сопряжения.
С. с. не обязательно означает неприменимость модели локализованных связей к рассматриваемой молекуле. Так, электронная заселенность локализованных мол. орбиталей вне σ-связей не превышает 1%. Так же хорошо локализованы и π-связи в сопряженных неароматич. системах (особенно когда учитывается альтернирование связей). Так, в линейных полиенах заселенность вне двухцентровых связей ок. 2%. Такие сопряженные системы описываются одной резонансной структурой со связями только между соседними атомами и без разделения формальных зарядов (см. резонанса теория), а их коллективные свойства удается рассматривать в рамках аддитивных моделей.
В то же время в ароматич. и некоторых др. системах, которые наилучшим образом описываются суперпозицией резонансных структур и где доли локализованных мол. орбиталей имеют большие веса вне связей (напр., в бензоле ок. 13%), С. с. обычно отождествляется с делокализацией связей. Экспериментально наблюдаемые коллективные свойства таких сопряженных систем в принципе нельзя представить в виде аддитивных функций свойств связей.
Наиб. существенной особенностью сопряженных систем с делокализованными связями является их повыш. термо-динамич. устойчивость. В ароматич. системах теплоты образования значительно выше, чем значения, найденные с учетом аддитивности локальных параметров, а связи характеризуются полной выравненностью длин (см. ароматичность). Количеств. мера повыш. термодинамич. устойчивости таких систем-энергия резонанса (сопряжения, дело-кализации). В сопряженных системах правилам аддитивности не подчиняются также параметры ЙК спектров, величины дипольных моментов и поляризуемости, диамагнитной восприимчивости и др. В этих случаях при расчете разл. характеристик вводят поправочные члены экзальтации и т. п.
Наличием С. с. объясняют характерное изменение геометрии молекулы — укорочение формально простых и удлинение формально кратных связей. Например, в полиенах длины простых связей C—C (0,151 нм) несколько укорочены по сравнению с длиной связи C—C в этане (0,154 нм). Количеств. мера изменения длин связей при сопряжении порядки связей между атомами: в 1,3-бутадиене порядки связей альтернируют (соотв., 1,894; 1,447; 1,894), а в аллильном катионе порядки связей между соседними атомами С равны.
Сопряженные системы с делокализованными связями представляют собой соед. с характсристич. электронными переходами, причем с удлинением цепи сопряжения повышается интенсивность и смещается поглощение в электронных спектрах в сторону больших длин волн (соотв. гипер-хромный эффект и батохромный сдвиг; см. цветность органических соединений).
Понятие о С. с. используют при рассмотрении реакц. способности. Например, электроф. присоединение к сопряженным диенам (см. диеновые углеводороды) приводит к смеси продуктов 1,2- и 1,4-присоединения.
Лит.: Базилевский М. В., Метод молекулярных орбит и реакционная способность органических молекул, М., 1969; Dewar М. I. S., Mc Кее М. L., "J. Amer. Chem. Soc.", 1978, v. 100, № 24, p. 7499–505; Cremer D., "Tetrahedron", 1988, v. 44, № 24, p. 7427–54.
М. Е. Клецкий
Значения в других словарях
- Сопряжение связей — Один из важнейших видов внутримолекулярного взаимного влияния атомов и связей в органических соединениях; обусловлено взаимодействием электронных систем атомов (прежде всего валентных электронов, см. Валентность). Большая советская энциклопедия
