свинца галогениды
СВИНЦА ГАЛОГЕНИДЫ
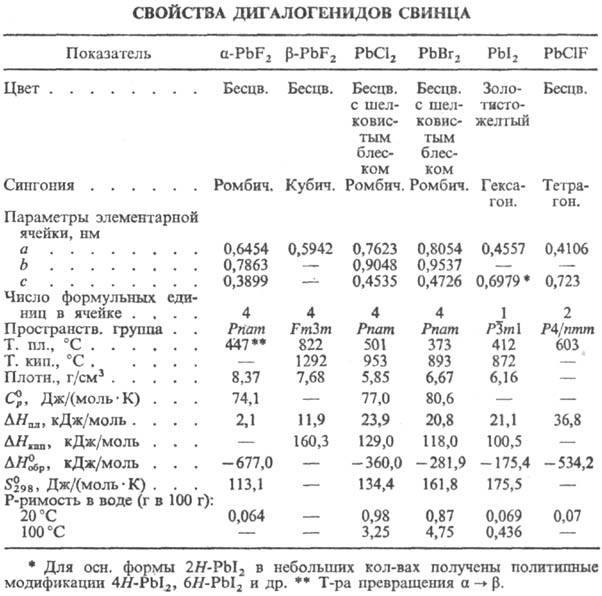
Дигалогениды PbХ2 (см. табл.) — кристаллы, устойчивы в сухом воздухе при обычной температуре, во влажном при нагр. гидролизуются; при нагр. на воздухе окисляются до оксигалогенидов типа Pb2OХ2, Pb5О4Х2, способность к окислению повышается в ряду F < Cl < Br < I. Растворимость в воде увеличивается при добавлении одноименных ионов Х− в связи с образованием комплексных анионов [PbХ3]− и [PbХ4]2−. Легко дают смешанные галогениды, напр. PbXF. Получают PbCl2, PbBr2 и PbI2 осаждением из водных растворов солей Pb(II) растворами, содержащими ион X−, очищают перекристаллизацией из подкисленных водных растворов, PbCl2 — взаимод. PbO с соляной кислотой, PbF2 — реакцией PbCO3 с фтористоводородной кислотой. В природе встречаются редкие минералы котунит PbCl2, матлокит PbClF.
Тетрафторид PbР4 — бесцветные кристаллы тетрагон. синто-нии (а = 0,424 нм, с = 0,8030 нм, пространственная группа I4/ттп); т. пл. ок. 600 °C; плотн. 6,7 г/см3; 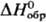 −942,1 кДж/моль; при нагр. разлагается с выделением F2 и фазы приблизит. состава PbF3; получают взаимод. PbF2 с F2. Тетрахлорид PbCl4-желтая жидкость; т. пл. −7 °C; плотн. 3,18 г/см3 (0 °C);
−942,1 кДж/моль; при нагр. разлагается с выделением F2 и фазы приблизит. состава PbF3; получают взаимод. PbF2 с F2. Тетрахлорид PbCl4-желтая жидкость; т. пл. −7 °C; плотн. 3,18 г/см3 (0 °C); 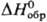 — 328,9 кДж/моль; взрывается ок. 100 °C; с HCl образует H2PbCl6; получают взаимод. [(C2H5)3NH]2PbCl6 с конц. H2SO4. Получены комплексные соед. М12[PbХ6], где X = Cl, F. Тетрабромид и тетраиодиды Pb неизвестны.
— 328,9 кДж/моль; взрывается ок. 100 °C; с HCl образует H2PbCl6; получают взаимод. [(C2H5)3NH]2PbCl6 с конц. H2SO4. Получены комплексные соед. М12[PbХ6], где X = Cl, F. Тетрабромид и тетраиодиды Pb неизвестны.
Дифторид PbF2 применяют как твердый электролит (β-PbP2; вместо чистого дифторида применяют также PbSnF4), для изготовления катодов в хим. источниках тока, как компонент керамики, эмалей, лазерных материалов, а также расплавов для выращивания монокристаллов оксидов металлов, как материал оптич. покрытий. Дихлорид PbCl2-промежут. продукт в производстве Pb, активатор люминофоров на основе ZnS; PbClF и PbI2 используют в ана-лит. химии при гравиметрич. определении Pb или F.
С. г. токсичны; ПДК 0,01 мг/м3 (в пересчете на Pb).
И. Н. Один
