свинец
СВИНЕЦ (Plumbum) Pb
хим. элемент IV гр. периодической системы, ат. н. 82, ат. м. 207,2. Природный С. состоит из пяти стабильных изотопов: 202Pb (следы), 204Pb (1,5%), 206Pb (23,6%), 207Pb (22,6%) и 208Pb (52,3%). Последние три изотопа-конечные продукты радиоактивного распада соотв. U, Ас и Th. В природе образуются и радиоактивные изотопы: 209Pb, 210Pb, 211Pb, 212Pb, 214Pb. Поперечное сечение захвата тепловых нейтронов прир. смеси ок. 0,2∙10−28 м2; хороший поглотитель рентгеновского и γ-из-лучения. Конфигурация внеш. электронной оболочки атома 6s26p2; степени окисления +2 (наиб. характерна) и +4; энергии ионизации Pb0 : Pb+ : Pb2+ равны соотв. 7,41678 и 15,0320 эВ; работа выхода электрона 4,05 эВ; электроотрицательность по Полингу 1,55; атомный радиус 0,175 нм, ионные радиусы (нм, в скобках даны координац. числа) Pb4+ 0,079 (4), 0,092 (6), Pb2+ 0,112 (4), 0,133(6).
Содержание С. в земной коре 1,6∙103% по массе, в водах Мирового океана 0,03 мкг/л (41,1 млн. т), в речных водах 0,2–8,7 мкг/л. Известно ок. 80 минералов, содержащих С., главнейший из них — галенит, или свинцовый блеск, PbS. Небольшое пром. значение имеют англезит PbSO4 и церус-сит PbCO3. В рудах С. сопутствуют Cu, Zn; Cd, благородные металлы, Bi, Те и др. ценные элементы. Прир. фон в атмосфере 2∙10−9-5∙10−4 мкг/м3. В теле взрослого человека содержится 7–15 мг С.
Свойства. С. — металл синевато-серого цвета, кристаллизуется в гранецентрир. кубич. решетке типа Cu, а — = 0,49389 нм, z = 4, пространственная группа Fm3m. С.-один из легкоплавких металлов, тяжелый цветной металл; т. пл. 327,50 °C, т. кип. 1751 °C; плотн., г/см3: 11,3415 (20 °C), 10,686 (327,6 °C), 10,536 (450 °C), 10,302 (650 °C), 10,078 (850 °C); 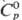 26,65 Дж/(моль∙К);
26,65 Дж/(моль∙К); 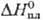 4,81 кДж/моль,
4,81 кДж/моль, 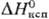 177,7 кДж/моль;
177,7 кДж/моль; 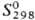 64,80 Дж/(моль∙К); давление пара, Па: 4,3∙10−7 (600 К), 9,6∙10−5 (700 К), 5,4∙10−2 (800 К). 1,2∙10−1 (900 К), 59,5 (1200 К), 8,2∙102 (1500 К), 12,8∙103 (1800 К). С. — плохой проводник тепла и электричества; теплопроводность 33,5 Вт/(м∙К) (менее 10% от теплопроводности Ag); температурный коэф. линейного расширения С. (чистотой 99,997%) в интервале температур 0–320 °C описывается уравнением: α = 28,15∙10−6t + 23,6∙10−9t2 °C−1; при 20 °C ρ 20,648 мкОм∙см (менее 10% от ρ Ag), при 300 °C и 460 °C соотв. 47,938 и 104,878 мкОм∙см. При −258,7 °C ρ С. падает до 13,11∙10−3 мкОм∙см; при 7,2 К он переходит в сверхпроводящее состояние. С. диамагнитен, магн. восприимчивость —0,12∙10−6. В жидком состоянии С. жидкотекуч, η в интервале температур 330–800 °C изменяется в пределах 3,2–1,2 мПа∙с; γ в интервале 330–1000 °C находится в пределах (4,44–4,01)∙10−3 Н/м.
64,80 Дж/(моль∙К); давление пара, Па: 4,3∙10−7 (600 К), 9,6∙10−5 (700 К), 5,4∙10−2 (800 К). 1,2∙10−1 (900 К), 59,5 (1200 К), 8,2∙102 (1500 К), 12,8∙103 (1800 К). С. — плохой проводник тепла и электричества; теплопроводность 33,5 Вт/(м∙К) (менее 10% от теплопроводности Ag); температурный коэф. линейного расширения С. (чистотой 99,997%) в интервале температур 0–320 °C описывается уравнением: α = 28,15∙10−6t + 23,6∙10−9t2 °C−1; при 20 °C ρ 20,648 мкОм∙см (менее 10% от ρ Ag), при 300 °C и 460 °C соотв. 47,938 и 104,878 мкОм∙см. При −258,7 °C ρ С. падает до 13,11∙10−3 мкОм∙см; при 7,2 К он переходит в сверхпроводящее состояние. С. диамагнитен, магн. восприимчивость —0,12∙10−6. В жидком состоянии С. жидкотекуч, η в интервале температур 330–800 °C изменяется в пределах 3,2–1,2 мПа∙с; γ в интервале 330–1000 °C находится в пределах (4,44–4,01)∙10−3 Н/м.
С. мягок, пластичен, легко прокатывается в тончайшие листы. Твердость по Бринеллю 25–40 МПа; σраст 12–13 МПа, σсж ок. 50 МПа; относит. удлинение при разрыве 50–70%. Значительно повышают твердость и прочность С. Na, Ca и Mg, но уменьшают его хим. стойкость. Медь увеличивает антикоррозионную стойкость С. (к действию H2SO4). С добавкой Sb возрастает твердость, а также кислотоупорность С. по отношению к H2SO4. Понижают кислотоупорность С. Bi и Zn, a Cd, Те и Sn повышают твердость и сопротивление усталости С. В С. практически не раств. N2, CO, CO2, O2, SO2, H2.
В хим. отношении С. довольно инертен. Стандартный электродный потенциал С. —0,1265 В для Pb0/Pb2+. В сухом воздухе не окисляется, во влажном-тускнеет, покрываясь пленкой оксидов, переходящей в присутствии CO2 в основной карбонат 2PbCO3∙Pb(OH)2. С кислородом С. образует ряд оксидов: Pb2O, PbO (глет), PbO2, Pb3O4 (сурик) и Pb2O3 (см. свинца оксиды). При комнатной температуре С. не реагирует с разб. серной и соляной кислотами, т. к. образующиеся на его поверхности труднорастворимые пленки PbSO4 и PbCl2 препятствуют дальнейшему растворению металла. Конц. H2SO4 (>80%) и HCl при нагр. взаимод. со С. с образованием растворимых соед. Pb(HSO4)2 и H4[PbCl6]. С. устойчив по отношению к фтористоводородной кислоте, водным растворам NH3 и щелочей и к мн. орг. кислотам. Лучшие растворители С. — разб. HNO3 и CH3COOH. При этом образуются свинца нитрат Pb(NO3)2 и свинца ацетат Pb(CH3COO)2. С. заметно раств. также в лимонной, муравьиной и винной кислотах.
Соли Pb(IV) м. б. получены электролизом подкисленных H2SO4 растворов солей Pb(II); важнейшие из них-свинца сульфат Pb(SO4)2 и ацетат Pb(OCOCH3)4. Соли С. легко гидро-лизуются. Pb — энергичный окислитель, поэтому, напр., не существуют PbI4 и PbBr4. При разряде свинцового аккумулятора Pb4+ также служит окислителем:
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
При взаимодействии оксидов Pb(IV) и Pb(II) с расплавами щелочей образуются соли — соотв. плюмбаты(IV) и плюмбиты(II), напр. Na2PbO3, Na2PbO2. С. медленно раств. в конц. растворах щелочей с выделением H2 и образованием М4[Pb(OH)6].
При нагревании С. реагирует с галогенами, образуя свинца галогениды. С азотистоводородной кислотой С. дает свинца азид Pb(N3)2, с серой при нагр. — сульфид PbS (см. свинца халькогениды). Гидриды для С. не характерны. В некоторых реакциях обнаруживают тетрагидрид PbH4 — бесцветный газ, легко разлагающийся на Pb и H2; образуется при действии разб. соляной кислоты на Mg2Pb.
• см. также свинца титанат, свинецорганические соединения
Получение. Осн. источник получения С. — сульфидные полиметаллич. руды. Селективной флотацией из руд, содержащих 1–5% Pb, получают свинцовые и др. концентраты. Свинцовый концентрат обычно содержит 40–75% Pb, 5–10% Zn, до 5% Cu, а также благородные металлы и Bi. Ок. 90% С. получают по технологии, включающей стадии: агломерирующий обжиг сульфидных концентратов, шахтная восстановит. плавка агломерата и рафинирование чернового С. Разрабатывают автогенные процессы плавки, позволяющие использовать тепло сгорания сульфидов.
Агломерирующий обжиг при традиц. производстве С. проводят на прямолинейных машинах с дутьем воздуха либо путем просасывания его. При этом PbS окисляется преим. в жидком состоянии: 2PbS + 3O2 → 2PbO + 2SO2. В шихту добавляют флюсы (SiO2, CaCO3, Fe2O3), которые, реагируя между собой и с PbO, образуют жидкую фазу, цементирующую шихту. В готовом агломерате С. в осн. концентрируется в свинцовосиликатном стекле, занимающем до 60% объема агломерата. Оксиды Zn, Fe, Si, Ca кристаллизуются в форме сложных соед., образуя жаропрочный каркас. Эффективная (рабочая) площадь агломерац. машин 6–95 м2.
В готовом агломерате содержится 35–45% Pb и 1,2–3% S, часть которой находится в виде сульфатов. Производительность агломерац. машин по агломерату зависит от содержания S в шихте и колеблется от 10 (бедные концентраты) до 20 т/(м2 ∙ сут) (богатые концентраты); по выжигаемой S она находится в пределах 0,7–1,3 т/(м2∙ сут). Часть газов, содержащих 4–6% SO2, используют для производства H2SO4. Степень утилизации S составляет 40–50%.
Полученный агломерат направляют на восстановит. плавку в шахтных печах. Печь для выплавки С. представляет собой шахту прямоугольного сечения, образуемую водо-охлаждаемыми коробками (кессонами). Воздух (или воздушно-кислородная смесь) подается в печь через спец. сопла (фурмы), расположенные по всему периметру печи в ниж. ряду кессонов. В шихту плавки входят в осн. агломерат и кокс, иногда загружают кусковое оборотное и вторичное сырье. Уд. проплав агломерата 50–80 т/(м2 ∙ сут). Прямое извлечение С. в черновой металл 90–94%.
Цель плавки-максимально извлечь С. в черновой металл, a Zn и пустую породу вывести в шлак. Осн. реакция шахтной плавки свинцового агломерата: PbOрасплав + CO → Pb + + CO2. В качестве восстановителя в шихту вводят кокс. Часть С. восстанавливается им непосредственно. Для восстановления С. требуется слабовосстановит. атмосфера (давление O2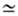 10−6–10−8 Па). Расход кокса к массе агломерата при шахтной плавке 8–14%. В этих условиях оксиды Zn и Fe не восстанавливаются и переходят в шлак. Медь присутствует в агломерате в форме CuO и CuS. Оксид меди в условиях шахтной плавки легко восстанавливается до металла и переходит в С. При высоком содержании Cu и S в агломерате при шахтной плавке образуется самостоят. фаза-штейн.
10−6–10−8 Па). Расход кокса к массе агломерата при шахтной плавке 8–14%. В этих условиях оксиды Zn и Fe не восстанавливаются и переходят в шлак. Медь присутствует в агломерате в форме CuO и CuS. Оксид меди в условиях шахтной плавки легко восстанавливается до металла и переходит в С. При высоком содержании Cu и S в агломерате при шахтной плавке образуется самостоят. фаза-штейн.
Осн. шлакообразующие компоненты шлаков (80–85% от массы шлака) — FeO, SiO2, CaO и ZnO-направляются на дальнейшую переработку для извлечения Zn. В шлак переходит до 2–4% Pb и ~20% Cu, содержание в нем этих металлов соотв. 0,5–3,5 и 0,2–1,5%. Образующаяся при шахтной плавке (и агломерации) пыль служит исходным сырьем для извлечения редких и рассеянных элементов.
В основе автогенных процессов выплавки С. лежит экзо-термич. реакция PbS + O2 → Pb + SO2, состоящая из двух стадий:
2PbS + 3O2:2PbO + 2SO2 PbS + 2PbO:3Pb + SO2
Преимущества автогенных способов перед традиц. техно-логией: исключается агломерац. обжиг, устраняется необходимость разбавления концентрата флюсами, что снижает выход шлака, используется тепло от горения сульфидов и исключается (частично) расход кокса, повышается извлечение SO2 с газами, что упрощает их использование и повышает безопасность на заводе. В промышленности применяют два автогенных процесса: КИВЦЭТ-ЦС, разработанный в СССР и осуществленный на Усть-Каменогорском заводе и в Италии на заводе Порто-Весме, и американский процесс QSL.
Технология плавки по методу КИВЦЭТ-ЦС: тонкоизмельченную, хорошо высушенную шихту, содержащую концентрат, оборотную пыль и кокс, с помощью горелки инжектируют техническим O2 в плавильную камеру печи, где происходит окисление сульфидов металлов, получение С. и формирование шлака. Газы (содержат 20–40% SO2) после очистки от пыли, возвращаемой в шихту плавки, поступают на производство H2SO4. Черновой С. и шлак через разделит. перегородку протекают в электротермич. печь-отстойник, откуда их выпускают через летки. Кокс подают в шихту для восстановления избыточного оксида С. в плавильной зоне.
Процесс QSL проводят в агрегате типа конвертера. Печь разделена перегородкой на зоны. В плавильной зоне происходит загрузка гранулир. концентрата, плавка и окисление расплава техническим O2. Шлак поступает во вторую зону, где с помощью фурм он продувается пылеугольной смесью для восстановления С. Во всех способах плавки осн. количество Zn (~80%) переходит в шлак. Для извлечения Zn, а также оставшегося С. и некоторых редких и рассеянных элементов шлак перерабатывают способом фьюмингования или вальцевания.
Черновой С., полученный тем или иным способом, содержит 93–98% Pb. Примеси в черновом С.: Cu (1–5%), Sb, As, Sn (0,5–3%), Al (1–5 кг/т), Au (1–30%), Bi (0,05–0,4%). Очистку чернового С. производят пирометаллургически или (иногда) электролитически.
Пирометаллургич. методом из чернового С. последовательно удаляют: 1) медь-двумя операциями: ликвацией и с помощью элементарной S, образующей сульфид Cu2S. Предварит. (грубую) очистку от Cu до содержания 0,5–0,7.% проводят в отражательных либо электротермических печах с глубокой свинцовой ванной, имеющей перепад температуры по высоте. Медь взаимод. на поверхности с сульфидным свинцовым концентратом с образованием Cu-Pb штейна. Штейн направляют в медное производство либо на самостоят. гидрометаллургич. переработку.
2) Теллур-действием металлич. Na в присутствии NaOH. Натрий селективно взаимод. с Те, образуя Na2Te, всплывающий на поверхность ванны и растворяющийся в NaOH. Плав идет на переработку для извлечения Те.
3) Олово, мышьяк и сурьму-окислением их либо O2 воздуха в отражат. печах при 700–800 °C, либо NaNO3 в присутствии NaOH при 420 °C. Щелочные плавы направляют на гидрометаллургич. переработку для регенерации из них NaOH и извлечения Sb и Sn; As выводят в виде Ca3(AsO4)2, который направляют на захоронение.
4) Серебро и золото — с помощью Zn, избирательно реагирующего с растворенными в С. благородными металлами; образуются AuZn3, AgZn3, всплывающие на поверхность ванны. Образовавшиеся съемы удаляют с поверхности для послед. переработки их на сплав Ag-Au. На этой стадии С. загрязняется Zn (0,5–0,8%).
5) Цинк-окислением воздухом либо NaNO3 в щелочном расплаве, хлорированием, а также отгонкой в вакууме.
6) Висмут-действием Ca, Mg, Sb. Предварительно вводят в ванну Ca и Mg, при этом образуется Bi2CaMg2, а в С. остается 0,008–0,01% Bi; затем добавляют в ванну, наряду с Ca и Mg, также Sb, при этом в С. остается 0,006–0,004% Bi. Полученные на предварит. стадии богатые съемы (дроссы) направляют на переработку для извлечения из них Bi. В свинцовой ванне остаются Ca, Mg, Sb.
7) Примеси Ca, Mg, Sb и Zn удаляют окислением NaNO3 в присутствии NaOH либо хлорированием.
Рафинирование С. осуществляют в стальных котлах полу-сферич. формы емкостью 50–300 т с открытой поверхностью ванны. Готовый С. разливают в чушки (~ 30 кг) либо блоки (~1 т). При электролитич. рафинировании чернового С'Г в качестве электролита используют водный раствор фторосили-ката С. (8–10% H2SiF6, 6–8% PbSiF6). Черновой С. предварительно рафинируют (пирометаллургически) от Sn и Cu. Электролиз проводят при напряжении на ванне 0,4–0,7 В, плотн. тока 130–180 А/м2 и температуре электролита 40–50 °C. Выход С. по току составляет 90–97%. Примеси С. концентрируются в анодном шламе.
Определение. С. определяют: по изменению степени мутности раствора, образующегося при взаимодействии Pb2+ с K2CrO4; колориметрически с дитизоном, амперометрич. титрованием с молибдатом аммония; спектрометрически с диэтилди-тиокарбаматом Na и 8-гидроксихинолином; хроматографически.
Применение. До 45% С. от общего потребления идет на производство электродов аккумуляторов; до 20%-на изготовление проводов и кабелей и покрытий к ним; 5–20% С.-на производство тетраэтилсвинца. С. используют для изготовления футеровки, труб и аппаратуры в хим. промышленности. Применяют свинца сплавы с Sn, Ca, содержащие Sb, Cu, As, Cd. В строительстве С. используют в качестве изоляции, уплотнителя швов, стыков, в т. ч. при создании сейсмостойких фундаментов. В военной технике С. применяют для изготовления шрапнели и сердечников пуль. Экраны из С. служат для защиты от радиоактивного и рентгеновского излучений.
По объему производства и потребления С. занимает четвертое место среди цветных металлов после А1, Cu и Zn. Производство С. в капиталистич. и развивающихся странах ок. 4,0 млн. т/год (1983). Осн. производители и потребители: США, ФРГ, Великобритания, Япония, Канада и Австралия.
С. был известен за 6–7 тыс. лет до н.э. народам Месопотамии, Египта и др. стран древнего мира.
С.-яд, вызывает профессиональные отравления. ПДК в воздухе рабочей зоны 0,01 мг/м3, атм. воздухе 0,003 мг/м3, воде 0,03 мг/л, почве 20,0 мг/кг. Осн. источники загрязнения С. окружающей среды: металлургич. предприятия (ежегодный выброс не менее 89 тыс.т), выхлопные газы двигателей внутр. сгорания (до 260 тыс. т/год), сточные воды пром. предприятий (выброс в Мировой океан 430–650 тыс. т/год) и др.
Лит.: Гудима Н.В., Шейн Я. П., Краткий справочник по металлургии цветных металлов, М., 1975; Смирнов М. П., Рафинирование свинца и переработка полупродуктов, М., 1977; Рабинович В. А., Хавин З.Я., Краткий химический справочник, Л., 1977; Зайцев В. Я., Маргулис Е. В., Металлургия свинца и цинка, М., 1985; Козин Л.Ф., Морачевский А. Г., Физико-химия и металлургия высокочистого свинца, М., 1991.
М. П. Смирнов
Значения в других словарях
- Свинец — (лат. Plumbum) Pb, химический элемент IV группы периодической системы Менделеева; атомный номер 82, атомная масса 207,2. С. — тяжёлый металл голубовато-серого цвета, очень пластичный, мягкий (режется ножом, царапается ногтем). Природный... Большая советская энциклопедия
- свинец — -нца, м. 1. Тяжелый мягкий ковкий и легкоплавкий металл синевато-серого цвета. Добыча свинца. Сплав свинца с сурьмой. 2. перен. Пуля. Человек, подкошенный свинцом, На траву свалился вверх лицом. Сурков, На меже. ◊ @ свинец на душе{ (или на сердце и т. Малый академический словарь
- свинец — Свине́ц/. Морфемно-орфографический словарь
- свинец — орф. свинец, -нца, тв. -нцом Орфографический словарь Лопатина
- свинец — Общеславянское – svinьcъ. Древнерусское – свиньцъ. Слово «свинец» известно в древнерусском языке с XI в. и восходит к общеславянскому сочетанию корня svin- и суффикса –ьсь>-ецъ. Этимологический словарь Семёнова
- свинец — Свинцом лечь (лежать; поэт.) — перен. тяжело (на сердце, на душе). ► -Это известие легло мне свинцом на душу. Фразеологический словарь Волковой
- Свинец — Свинец — металл, известный еще в древности. С. добывали в Египте и на Синайском полуо-ве, а также привозили в Тир из Фарсиса (Иез 27:12). При перечислении захвач. у мадианитян трофеев С. среди металлов называется последним (Чис 31:22), т.к. Библейская энциклопедия Брокгауза
- Свинец — (Исх 15:10, Чис 31:22, Иез 27:12, Ам. 7:7) — один из металлов синевато-серого цвета с сильным металлическим оттенком, хорошо известный с самых древних времен. Моисей упоминает о нем в своей победной песни. Библейская энциклопедия архим. Никифора
- свинец — Общеслав. Суф. производное (суф. -ьць > -ец) от той же основы (свин-), что латышск. svins «свинец». Этимологический словарь Шанского
- СВИНЕЦ — СВИНЕЦ (символ Рb), металлический элемент IV группы периодической таблицы. Его основная руда — ГАЛЕНИТ (сульфид свинца), из нее добывают свинец путем обжига. Воздействие на организм свинца, содержащегося в красках, трубах, бензине и др. Научно-технический словарь
- Свинец — Pb (лат. plumbum * a. lead, plumbum; н. Blei; ф. plomb; и. plomo), — хим. элемент IV группы периодич. системы Mенделеева, ат.н. 82, ат. м. 207,2. Природный C. Горная энциклопедия
- Свинец — (Plumbum; Pb) химический элемент IV группы периодической системы Д.И. Менделеева, атомный номер 82, атомная масса 207,2; тяжелый мягкий синевато-серый металл; С. и его соединения токсичны для человека; используется, например, для защиты от ионизирующего излучения. Медицинская энциклопедия
- свинец — • Холодный (Полежаев). Словарь литературных эпитетов
- свинец — СВИНЕЦ, нца, м. Мягкий, ковкий, тяжёлый металл синевато-серого цвета. Врагов встретили свинцом (перен.: стрельбой, пулями). Лечь свинцом на сердце (перен.: о чёмн. тяжёлом, гнетущем). Голова как свинцом налита (об ощущении тяжести, боли в голове; разг.). Толковый словарь Ожегова
- свинец — СВИН’ЕЦ, свинца, мн. нет, ·муж. 1. Мягкий, очень тяжелый металл синевато-серого цвета. Пломба из свинца. Расплавленный свинец. 2. перен. Пуля; собир. пули (·поэт. ). «Засвищет вкруг меня губительный свинец.» Пушкин. «С свинцом в груди, лежал недвижим... Толковый словарь Ушакова
- свинец — СВИНЕЦ -нца; м. 1. Химический элемент (Pb), тяжёлый мягкий ковкий металл синевато-серого цвета (применяется в производстве аккумуляторов, защитных оболочек от вредных излучений, в типографском деле и т.п.). Добыча свинца. Сплав свинца с сурьмой. Толковый словарь Кузнецова
- свинец — СВИНЕЦ м. крушец, металл, один из самых мягких и веских, цветом посинее олова; встарь зывали его оловом, откуда и поговорка: слово олово, т. е. веско. В Васильев вечер лить олово, свинец, воск. Ружейные пули свинцовые. Толковый словарь Даля
- Свинец — (медико-санит. очерк) Токсикология С. и его соединений. — В древние времена отравления С. вызывались бывшей в большом ходу свинцовой посудой. Случаи отравления и ныне встречаются весьма часто, вследствие чрезвычайно обширного применения... Энциклопедический словарь Брокгауза и Ефрона
- СВИНЕЦ — СВИНЕЦ (лат. Plumbum) — Pb, химический элемент IV группы периодической системы Менделеева, атомный номер 82, атомная масса 207,2. Синевато-серый металл, тяжелый, мягкий, ковкий; плотность 11,34 г/см3, tпл 327,4 °С. Большой энциклопедический словарь
- свинец — свинец м. 1. Тяжелый мягкий легкоплавкий металл синевато-сероватого цвета. 2. перен. То же, что пуля I Толковый словарь Ефремовой
- свинец — свине́ц род. п. -нца́, укр. свине́ць, род. п. свинця́, свинцю́, др.-русск., цслав. свиньць – то же, словен. svínǝc, род. п. svínca. Родственно лит. švìnas "свинец", лтш. svins; дальнейшие родственные связи недостоверны – с греч. κύανος... Этимологический словарь Макса Фасмера
