Тафеля уравнение
ТАФЕЛЯ УРАВНЕНИЕ
осн. соотношение электрохимической кинетики. Связывает перенапряжение электродного процесса η (сдвиг потенциала электрода по отношению к его равновесному значению; см. поляризация) с плотностью тока i, протекающего через границу электрод |раствор: η=a + blgi (а и b-эмпирич. постоянные). Установлено Ю. Тафелем опытным путем в 1905 применительно к электрохим. реакции 2H3O+ + 2е = H2 + 2H2O, при этом использовались электроды из разл. металлов. Пытаясь дать теоре-тич. обоснование уравнению, Тафель предположил, что за обратимой стадией разряда H3O+ + е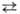 Hадс + H2O следует лимитирующая (замедленная) стадия рекомбинации адсорбированных на электроде атомов водорода: 2Hадс : H2. В дальнейшем, однако, было показано, что приведенное Т. у. является частным случаем более общего уравнения, связывающего значения i и η в рамках теории замедленного разряда. Эмпирич. постоянная а оказывается связанной с кинетич. параметром стадии разряда-коэф. переноса α (0
Hадс + H2O следует лимитирующая (замедленная) стадия рекомбинации адсорбированных на электроде атомов водорода: 2Hадс : H2. В дальнейшем, однако, было показано, что приведенное Т. у. является частным случаем более общего уравнения, связывающего значения i и η в рамках теории замедленного разряда. Эмпирич. постоянная а оказывается связанной с кинетич. параметром стадии разряда-коэф. переноса α (0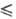 α
α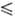 1), а постоянная b — с током обмена i0: a= -(RT/αnF)lni0; b = 2,3RT/αnF, где n — число электронов, участвующих в стадии разряда, F — постоянная Фарадея.
1), а постоянная b — с током обмена i0: a= -(RT/αnF)lni0; b = 2,3RT/αnF, где n — число электронов, участвующих в стадии разряда, F — постоянная Фарадея.
Лит.: Дамаскин Б. Б., Петрий О. А., Введение в электрохимическую кинетику, М., 1983, с. 238.
Б. Б. Дамаскин
