тантал
ТАНТАЛ (по имени героя др.-греч. мифологии Тантала, осужденного на вечную неутолимую жажду; назван так из-за трудности получения его в чистом виде; лат. Tantalum) Ta
хим. элемент V гр. периодической системы, ат. н. 73, ат. м. 180,9479. В природе два изотопа: стаб. 181Та (99,9877%) и радиоактивный 180Та (0,0123%, β-излучатели, Т1/2 1∙1013 лет). Поперечное сечение захвата тепловых нейтронов 2,13∙10−27 м2. Конфигурация внеш. электронных оболочек атома 5s25р65d36s2; степень окисления +5, значительно реже + 4, +3 и +2; энергии ионизации Та0 : Та+ : Та2+ соотв. 7,89 и 16,2 эВ; электроотрицательность по Полингу 1,5; атомный радиус 0,146 нм, ионные радиусы, нм (в скобках указаны координац. числа): Та3+ 0,086(6), Та4+ 0,082(6), Та5+ 0,078 (6), 0,083 (7), 0,088(8).
Содержание Т. в земной коре 2,5∙10−4% по массе. Встречается в природе обычно вместе с Nb. Входит в состав неск. десятков минералов, представляющих собой тантало-нио-баты или титано-тантало-ниобаты. Важнейшие из них — колумбит-танталит и пирохлор (см. ниобий), микролит-разновидность пирохлора с содержанием 55–74% Та2O5. Т. содержится также в касситерите (см. олово), при переработке которого Т. переходит в шлаки восстановит. плавки (11–15%, иногда до 30% Та2O5). Месторождения Т. имеются в Нигерии, Канаде, Бразилии, СНГ, Австралии, Заире, Малайзии, Мозамбике и Таиланде. Общие мировые запасы Т. в 1980 оценивались в 254 тыс. т, в пром. месторождениях-ок. 65, 3 тыс. т.
Свойства. Т. — блестящий серебристо-серый металл; кристаллич. решетка кубическая объемноцентрированная, а = 0,3296 нм, z = 2, пространственная группа Iт3т. Т. пл. 3014 °C, т. кип. ок. 5500 °C; плотн. 16,60 г/см3 (20 °C); 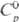 25,39 Дж/(моль∙К); ΔHпл 34,8 кДж/моль (3287 К),
25,39 Дж/(моль∙К); ΔHпл 34,8 кДж/моль (3287 К), 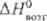 787 кДж/моль (298 К),
787 кДж/моль (298 К), 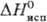 751 кДж/моль (5773 К);
751 кДж/моль (5773 К); 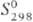 41,6 Дж/(моль∙К); температура перехода в сверхпроводящее состояние 4,45 К; уравнение температурной зависимости давления пара: lgp(Па) = 13,98-41600/T-lgT (2200–3263 К); температурный коэф. линейного расширения 6,5∙10−6 К−1 (293--393 К) и 8,0∙10−6 K−1 (293–1773 К); теплопроводность 54,43 Вт/(м∙К) при 293 К; ρl,32∙10−7(0 °C) и 8,7∙10−7 Ом∙м (2000 °C), температурный коэф. ρ 3,82∙10−3 К−1 (0–100 °C). Т. парамагнитен, уд. магн. восприимчивость +9,49∙10−7 (18 °C). Имеет очень малую величину работы выхода электронов (6,60∙10−19 Дж).
41,6 Дж/(моль∙К); температура перехода в сверхпроводящее состояние 4,45 К; уравнение температурной зависимости давления пара: lgp(Па) = 13,98-41600/T-lgT (2200–3263 К); температурный коэф. линейного расширения 6,5∙10−6 К−1 (293--393 К) и 8,0∙10−6 K−1 (293–1773 К); теплопроводность 54,43 Вт/(м∙К) при 293 К; ρl,32∙10−7(0 °C) и 8,7∙10−7 Ом∙м (2000 °C), температурный коэф. ρ 3,82∙10−3 К−1 (0–100 °C). Т. парамагнитен, уд. магн. восприимчивость +9,49∙10−7 (18 °C). Имеет очень малую величину работы выхода электронов (6,60∙10−19 Дж).
Примеси H, N, С и О снижают пластичность и повышают твердость Т. Чистый Т. легко обрабатывается давлением на холоду; жаропрочен; σраст при 293 К отожженного образца высокой чистоты 280–330 МПа, неотожженного 600–1400 МПа; относит. удлинение отожженного и неотожженного образцов соотв. 20–35 и 2–20%; твердость по Бринеллю чистого отожженного образца 500 МПа. Т. не переходит в хрупкое состояние до −211 °C.
Химически Т. очень инертен. В компактном виде начинает окисляться на воздухе выше 300 °C, устойчив к действию сухих Br2 и I2 при 150 °C, взаимод. с Cl2 выше 200 °C (см. тантала галогениды), с H2-выше 250 °C (интенсивно — при 300 °C), с P2-выше 250 °C, с С и углеводородами — при 800–1100 °C. Ниже 150 °C не раств. в царской водке, при обычной температуре — в соляной, фосфорной и серной кислотах, не реагирует с большинством др. кислот, водным NH3, водными растворами солей, орг. веществами. Не взаимод. с разб. растворами щелочей, но медленно раств. в их конц. горячих растворах. Устойчив к большинству расплавл. металлов (Li, Na, К, Cu, Cd, Hg, Sn, Pb, Bi), но корродирует в расплавл. Fe, Ni и Со. Раств. во фтористоводородной кислоте, ее смесях с HNO3, в горячих конц. H2SO4 и H3PO4, в расплавл. щелочах и NH4HF2.
На воздухе Т. покрывается тончайшей пленкой тантала оксидов. Обратимо поглощает H2 с образованием твердого раствора внедрения (до 30 ат. %Н) и гидрида состава Та2Н (тетрагон. кристаллич. решетка, а = 0,338 нм, с = 0,341 нм). Растворимость H2(мг в 100 г Т.) меняется от 417 при 17 °C до 6,66 при 1300 °C, выше 1500 °C-близка к нулевой. Макс. содержанию растворенного H2 соответствует формула ТаH0,78. Гидриды Т. образуются также при электролизе кислот с катодом из Т., при восстановлении Та2O5 гидридом Са; при взаимодействии TaCl5 с C6H5MgBr в атмосфере H2 получены ТаН, ТаH2 и ТаH3. Гидрирование Т. и дегидрирование при нагр. используют для Получения мелкодисперсного Т.
При взаимодействии с углем Т. дает карбиды Та2С и ТаС. В системе Та-С установлено существование трех фаз: α (твердый раствор С в Т) и с недостатком С (структуры вычитания)-β(Та2С) и γ(ТаС). При 150 °C Т. растворяет 0,02% по массе С; при содержании С в Та до 2,46% присутствуют α- и β-фазы, при содержании 2,46–3,21%-Та2С (ТаC0,38 - 0,50), в области концентраций С 3,21–3,71% -β- и γ-фазы, в области 3,71–5,7%-ТаС (ТаC0,58_0,91). Параметры кристаллич. решетки гексагон. β-фазы изменяются в пределах: а = 0,31030–0,31044 нм, с = 0,49367–0,49430 нм; кубич. гранецентрир. γ-фазы — в пределах 0,44206–0,44564 нм. Для Та2С: плотн. 15,22 г/см3; 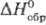 - 208,7 кДж/моль;
- 208,7 кДж/моль; 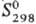 81,7 Дж/(моль∙К). Золотисто-желтый монокарбид ТаС имеет т. пл. ок. 3800 °C; плота. 14,4 г/см3;
81,7 Дж/(моль∙К). Золотисто-желтый монокарбид ТаС имеет т. пл. ок. 3800 °C; плота. 14,4 г/см3; 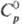 36,8 Дж/(моль∙К);
36,8 Дж/(моль∙К); 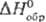 −142 кДж/моль;
−142 кДж/моль; 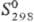 42,4 Дж/(моль∙К); весьма устойчив к хим. реагентам; на воздухе ниже 1000 °C не окисляется; раств. только в смеси HF-HNO3; при нагр. реагирует с N2 и NH3, образуя нитриды.
42,4 Дж/(моль∙К); весьма устойчив к хим. реагентам; на воздухе ниже 1000 °C не окисляется; раств. только в смеси HF-HNO3; при нагр. реагирует с N2 и NH3, образуя нитриды.
В системе Ta-N существуют 4 фазы (нитриды): β(TaN0,05), γ(TaN0,40_0,45), d(TaN0,8_0,9) и ε (TaN). β-Фаза имеет кубич. кристаллич. решетку (а = 0,3369 нм;, остальные-гексагональную с параметрами: для γ-фазы а = 0,3041–0.3048 нм, с = 0,4907–0,4918 нм; для d-фазы а = 0,2925–0,2938 нм, с = 0,2876–0,2883 нм; для ε-фазы а = 0,518 нм, с = 0,2908 нм. При нагр. до 2800–3000 °C нитриды Т. теряют азот, превращаясь в α-фазу (раствор азота в Т.). Нитриды Т. очень устойчивы к действию разл. хим. веществ. TaN голубовато-серого или черного цвета; плотн. 14,36 г/см3; 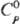 42,7 Дж/(моль∙К); Δ
42,7 Дж/(моль∙К); Δ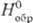 −252,7 кДж/моль;
−252,7 кДж/моль; 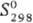 41,9 Дж/(моль∙К). Нитриды TaN и Ta2N образуют твердые растворы соотв. с ТаС и Та2С. Описана фаза Ta3N5 (красного цвета), образующаяся при взаимодействии Та2O5 с NH3 при 860–920 °C в присутствии Ti. Она кристаллизуется в тетрагон. сингонии (а = 1,02265 им, с = 0,3898 нм, z = 4); плотн. 9,85 г/см3. При высоком давлении N2 получают Ta5N6.
41,9 Дж/(моль∙К). Нитриды TaN и Ta2N образуют твердые растворы соотв. с ТаС и Та2С. Описана фаза Ta3N5 (красного цвета), образующаяся при взаимодействии Та2O5 с NH3 при 860–920 °C в присутствии Ti. Она кристаллизуется в тетрагон. сингонии (а = 1,02265 им, с = 0,3898 нм, z = 4); плотн. 9,85 г/см3. При высоком давлении N2 получают Ta5N6.
С фосфором Т. образует фосфиды ТаР и Та2Р, с As-ap-сениды TaAs и TaAs2, с Sb-антимониды Ta3Sb, Ta5Sb4, TaSb2, с S-сульфиды TaS3 и TaS2.
Известно 4 устойчивых кристаллич. силицида: TaSi2 (т. пл. ок. 2200 °C, гексагон. кристаллич. решетка, а = 0,4781 ям, с = 0,6534 нм, плота. 9,14 г/см3), Ta5Si3 (т. пл. ок. 2500 °C, имеет две тетрагон. кристаллич. модификации, для низкотемпературной а = 0,6516 нм, с = 1,1872 нм), Ta2Si (т. пл. ок. 2450 °C, тетрагон. кристаллич. решетка, a = 0,6157нм, с = 0,5039 нм) и Ta9Si2 (т. пл. ок. 2500 °C, гексагон. кристаллич. решетка, a = 0,6105нм, с = 0,4918 нм). Компактный TaSi2 устойчив к окислению на воздухе до 1000 °C и выше. Взаимод. с фтористоводородной кислотой и расплавл. щелочами, устойчив к действию др. минеральных кислот и разб. растворов щелочей.
С бором Т. образует бориды ТаВ2 (т. пл. ок. 3200 °C), ТаВ (т. пл. ок. 2000 °C), а также инконгруэнтно плавящиеся Та2В, Та3В2, Та3В4.
Бесцв. сульфат Ta2(SO4)5 гидролизуется водой, при нагр. выше 100 °C разлагается с выделением SO3. Выделены также Ta2O4SO4∙3H2O и соли типа (NH4)3Та(SO4)4. Фосфаты Т. имеют состав Та3(PO4)5 и ТаОPO4. Возможно существование гидрофосфатов, а также пирофосфата (ТаO2)4P2O7. Соли гилотетич. танталовых кислот — танталаты получают спеканием Та2O5 с оксидами металлов.
• см. также танталорганические соединения
Получение. Большую часть Т. получают из пирохлоровых и танталит-колумбитовых концентратов и из шлаков оловянной плавки. Руды обогащают гравитац. методами и флотацией, а также электромагн. или радиометрич. сепарацией. Содержание Та2O5 и Nb2O5 в концентратах достигает 50%. Концентраты и шлаки перерабатывают преим. до Та2O5 иди K2[TaF7] (значительно реже до TaCl5), из которых затем получают металлические Т. Концентраты и шлаки подвергают выщелачиванию действием фтористоводородной кислоты с послед. очисткой; Nb и Та разделяют экстракцией трибутилфосфатом, циклогексаноном или метилизобутил-кетоном, реже — др. экстрагентами. Из водной фазы действием водным NH3 осаждают гидроксид Т. (который сушат и прокаливают до Та2O5) или действием KF осаждают K2TaF7.
По хлоридному способу концентрат смешивают с углем или коксом, брикетируют и хлорируют брикеты в шахтной печи при 700–800 °C или фторируют непосредственно смесь мелкоизмельченных концентрата и кокса в солевом хлорид-ном расплаве, содержащем NaCl и KCl. Далее конденсируют образовавшиеся летучие пентахлориды Nb и Та, разделяют и очищают ректификацией. Оксид Та2O5 получают гидролизом TaCl5 с послед. прокаливанием осадка гидроксида Т. Иногда хлорированию подвергают феррониобий или отходы металла.
По сульфатному способу концентраты обрабатывают конц. H2SO4 или ее смесью с (NH4)2SO4 при 150–300 °C, выщелачивают сульфаты водой, отделяют осадок, разделяют и очищают Та и Nb экстракцией из фторидных сред, а затем выделяют Та2O5 или K2TaF7. Разрабатывают способы экстракционного разделения Та и Nb непосредственно из сульфатных растворов.
Металлические Т. получают натриетермич. восстановлением K2TaF7 или электролитич. восстановлением из расплава K2TaF7-Ta2O5-KF-KCl. После отмывки полученного порошка Т. от примесей его брикетируют, спекают в штабики, которые переплавляют в вакууме в электродуговых и электроннолучевых печах.
Металлические Т. можно получить восстановлением Та2O5-карботермически, алюмотермически или нагреванием в смеси с ТаС в вакууме при 2700 °C.
Описаны спосрбы переработки концентратов Т. с использованием жидких или газообразных фторирующих реагентов.
Мировое производство (в развитых странах) Т. в виде металла и сплавов ок. 700 т (1985); в т. ч. 2/3 из шлаков оловянной плавки.
Определение. Для определения Т. применяют те же методы, что и для ниобия. Главная трудность-сходство хим. свойств Nb и Та, проявление эффекта "потери индивидуальности" Т. в присутствии Nb и Ti. Для разделения этих элементов применяют осаждение Т. из растворов таннином, экстракцию, напр. кетонами из растворов в смеси кислот HCl-HF, купфероном и др., хроматографич. методы. Количественно Т. определяют колориметрически (с использованием пирогаллола и др.), гравиметрически, люминесцентным, рентгеноспект-ральными, флуоресцентными, спектральными и нейтронно-активационным методами.
Применение. Ок. 35–45% производимого Т. используют в виде порошка для электролитич. конденсаторов и при производстве деталей электронных приборов, ок. 20–25% — в виде карбидов (ТаС входит в состав некоторых твердых сплавов; см. тантала сплавы), ок. 15–20% — в виде проката, а также присадок к сплавам (напр., добавка Т. в нержавеющие стали повышает их коррозионную устойчивость), ок. 3–6% — в виде оксидов для ферросплавов. Из Т. изготовляют аноды, сетки, катоды и др. детали электронных ламп, его применяют в качестве геттера. В хим. промышленности Т. служит материалом теплообменников, нагревателей, зондов для измерения температуры, кислотоупорной облицовки аппаратов. Из Т. изготовляют тигли для вакуумного напыления и плавки металлов, фторидов и оксидов. Т. — уникальный биосовместимый материал, в медицине его используют для костного протезирования. Нитрид TaN применяют в виде устойчивых к истиранию покрытий, ТаSi2 — при изготовлений структур металл-оксид-полупроводник, защитных и нротивоотражательных покрытий.
• см. также лития танталат
Т. открыт в 1802 А. Экебергом. В виде пластичного металла впервые получен в 1905 В. Болтоном.
Лит.: Константинов В. И., Электролитическое получение тантала, ниобия и их сплавов, М., 1977; West wood W. D., Waterhouse N., Wi Icox P. S, Tantalum thin films, L∙, 1975. См. также лит. при ст. ниобий.
Э. Г. Раков, М. В. Мелкумянц
Значения в других словарях
- тантал — орф. тантал, -а (металл) Орфографический словарь Лопатина
- Тантал — I Танта́л в древнегреческой мифологии лидийский или фригийский царь, сын Зевса, отец Пелопса и Ниобы (См. Ниоба). За то, что разгласил тайны олимпийцев, похитил с пира богов нектар и амбросию и, пригласив богов на пир, угостил их блюдом... Большая советская энциклопедия
- тантал — -а, м. 1. (с прописной буквы). Герой древнегреческой мифологии, осужденный богами на вечные мучения: страдать от голода и жажды, несмотря на близость воды и плодов. 2. Химический элемент, твердый тугоплавкий металл серо-стального цвета. Малый академический словарь
- тантал — Танта́л/ (металл). Морфемно-орфографический словарь
- Тантал — Тантал (миф.) Орфографический словарь. Одно Н или два?
- Тантал — • Tantălus, Τάνταλος 1. богатый царь фригийский, царствовавший в стране у горы Сипила (называемый также царем лидийским, пафлагонским, коринфским, аргосским), сын Зевса (или Тмола) и Плуто, богини богатства, отец Пелопса... Словарь классических древностей
- Тантал — орф. Тантал, -а: муки Тантала Орфографический словарь Лопатина
- ТАНТАЛ — ТАНТАЛ (символ Та), редко встречающийся блестящий голубовато-серый металл, химический элемент, открытый в 1802 г. Его основной источник — колумбит-танталит. Научно-технический словарь
- Тантал — Ta (по имени героя др.-греч. мифологии Тантала; лат. Tantalum * a. tantalum; н. Tantal; ф. tantale; и. tantalo), — хим. элемент V группы периодич. системы Менделеева, ат. н. 73, ат. м. 180,9479. Горная энциклопедия
- ТАНТАЛ — ТАНТАЛ — герой трагедии Вяч.И.Иванова «Тантал» (1904). В греческой мифологии Т.- сын Зевса и нимфы Плуто, царь Сипила во Фригии, наказанный за оскорбление олимпийских богов вечными муками. Этот миф послужил сюжетом утраченной трагедии Софокла «Тантал». Энциклопедия литературных героев
- Тантал — (Tantalum; Та) химический элемент V группы периодической системы Д.И. Менделеева; атомный номер 73, атомная масса 180,948; биологически инертный, тяжелый, тугоплавкий металл; применяется в медицине, например, в качестве шовного материала. Медицинская энциклопедия
- ТАНТАЛ — (Τάνταλος) в греческой мифологии герой, сын Зевса и Плуто, царствовавший в области горы Сипила в южной Фригии (Малая Азия) и славившийся своим богатством. По одной из версий мифа, он был женат на дочери бога златоносной реки Пактола. Мифологическая энциклопедия
- тантал — ТАНТАЛ -а; м. [греч. Tantalos] Химический элемент (Та), твёрдый тугоплавкий металл серо-стального цвета (используется в медицине и технике). ◊ Муки Тантала. Мучения, вызываемые созерцанием желанной цели и сознанием невозможности её достичь. Толковый словарь Кузнецова
- тантал — ТАНТАЛ, а, м. Тяжёлый тугоплавкий металл светло-серого цвета. | прил. танталовый, ая, ое. Танталовые руды. Толковый словарь Ожегова
- тантал — ТАНТ’АЛ, тантала, мн. нет, ·муж. (·лат. tantalum) (·хим. ). Очень твердый, тугоплавкий и ковкий металл серого цвета, встречающийся редко и только в некоторых минералах. (Названо по имени Тантала, героя греческой мифологии, в связи с трудностью добычи этого металла; ср. Танталовы муки.) Толковый словарь Ушакова
- тантал — ТАНТАЛ м. один из открытых химиками металлов. Толковый словарь Даля
- тантал — Тантала, мн. нет, м. [лат. tantalum] (хим.). Очень твердый, тугоплавкий и ковкий металл серого цвета, встречающийся редко и только в нек-рых минералах. [Названо по имени Тантала, героя греческой мифологии, в связи с трудностью добычи этого металла; ср. Танталовы муки.] Большой словарь иностранных слов
- тантал — 1. тантал м. Химический элемент, редкий, очень твёрдый и тугоплавкий металл серого цвета, применяемый для изготовления химической аппаратуры, хирургических инструментов, электровакуумных приборов. 2. Тантал... Толковый словарь Ефремовой
- Тантал — (Τάνταλος, Tantalus) — царь Сипила во Фригии (Лидии), сын Зевса и нимфы Плуто, отец Пелопа и Ниобы, дед Атрея и Тиеста. Как любимец богов, он имел доступ к их советам и пирам. Энциклопедический словарь Брокгауза и Ефрона
