теллур
ТЕЛЛУР (от лат. tellus, род. падеж telluris — Земля; лат. Tellurium) Te
хим. элемент VI гр. периодической системы, относится к халькогенам, ат. н. 52, ат. м. 127,60. Природный Т. состоит из восьми изотопов: 120Те (0,089%), 122Те (2,46%), 123Те (0,89%), 124Те (4,74%), 125Те (7,03%), 126Те (18,72%), 128Те (31,75%) и 130Те (34,27%). Конфигурация внеш. электронной оболочки 5s2 5p4; степени окисления −2, +4, +6, редко +2; энергия ионизации при последоват. переходе от Те0 к Те6+ 9,010, 18,6, 28,0, 37,42, 58,8, 72,0 эВ; сродство к электрону ~ 2 эВ; электроотрицательность по Полингу 2,10; атомный радиус 0,17 нм, ионные радиусы, нм (в скобках указаны координац. числа): Те2 0,207(6), Те4+ 0,066(3), 0,80(4), 0,111(6), Те6+ 0,057(4), 0,070(6).
Содержание в земной коре 1∙10 % по массе. Известно ок. 100 минералов Т., в т. ч. самородный Т., алтаит PbТе, гессит Ag2Te, сильванит AuAgTe4, калаверит AuТе2, тетра-димит Bi2Te2S. Т. входит в качестве изоморфной примеси в сульфидные минералы-халькопирит, галенит, пирит, пентландит и др. Т. извлекают в осн. из медных, свинцовых, пиритных руд, где он находится как в рассеянном состоянии, так и в виде микровкрапленностей собств. минералов. Известны золото-теллуровые месторождения с собственно теллуровой минерализацией, не имеющие существенного значения.
Свойства. Т. — серебристо-серое вещество с металлич. блеском, в тонких слоях на просвет-красно-коричневого цвета, в парах-золотисто-желтый. Кристаллизуется в гексагон. решетке, а = 0,44566 нм, с = 0,59268 нм, z = 3, пространственная группа P3121; структура состоит из параллельно расположенных спиральных цепочек; плотн. 6,247 г/см3. Т. наз. аморфный Т. с плотн. ~ 5,9 г/см3, получаемый осаждением из растворов, представляет собой микродисперсный кристаллический Т. При давлении ~ 4,2 ГПа при 25 °C образуется модификация TeII со структурой типа β-Sn, а при ~6,3 ГПа-ТеIII с ромбоэдрич. структурой; обе модификации имеют металлич. свойства. Т. пл. 449,8 °C, т. кип. 990 °C; 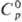 25,8 Дж/(моль∙К);
25,8 Дж/(моль∙К); 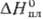 17,5 кДж/моль,
17,5 кДж/моль, 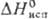 51,0 кДж/моль;
51,0 кДж/моль; 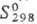 49,46 Дж/(моль∙К); теплопроводность 1,8 Вт/(м∙К)∙ температурный коэф. линейного расширения 0,2∙10−6 К−1; уравнения температурной зависимости давления пара для кристаллического Т. lgp (мм рт. ст.) = = 19,667 — 9232/T+ 2,100 lg T+ 2,308∙10−3 Т (298 — 723 К), для жидкого lgp (мм рт. ст.) = 6,402 — 6016/Т — −0,4001gT(723-_1263 K); ρ 3,7∙109 Ом∙м, температурный коэф. ρ 3,79∙10−3 К−1; полупроводник p-типа, ширина запрещенной зоны 0,32 эВ. Расплав Т. выше ~ 700 °C обладает металлической проводимостью. Т. диамагнитен, магн. восприимчивость — 0,31∙10−9. Твердость по Моосу 2,3, по Бринеллю 180–270 МПа; сопротивление разрыву 10,8 МПа. Т. хрупок, при нагревании становится пластичным.
49,46 Дж/(моль∙К); теплопроводность 1,8 Вт/(м∙К)∙ температурный коэф. линейного расширения 0,2∙10−6 К−1; уравнения температурной зависимости давления пара для кристаллического Т. lgp (мм рт. ст.) = = 19,667 — 9232/T+ 2,100 lg T+ 2,308∙10−3 Т (298 — 723 К), для жидкого lgp (мм рт. ст.) = 6,402 — 6016/Т — −0,4001gT(723-_1263 K); ρ 3,7∙109 Ом∙м, температурный коэф. ρ 3,79∙10−3 К−1; полупроводник p-типа, ширина запрещенной зоны 0,32 эВ. Расплав Т. выше ~ 700 °C обладает металлической проводимостью. Т. диамагнитен, магн. восприимчивость — 0,31∙10−9. Твердость по Моосу 2,3, по Бринеллю 180–270 МПа; сопротивление разрыву 10,8 МПа. Т. хрупок, при нагревании становится пластичным.
Для Т. нормальный электродный потенциал 0,56 В. Т., даже дисперсный, устойчив на воздухе, но при нагр. горит (пламя голубое с зеленым ореолом) с образованием TeO2 (см. теллура оксиды). Кристаллический Т. реагирует с водой выше 100 °C, аморфный-выше 50 °C. Конц. растворы щелочей растворяют Т. с образованием теллуридов и теллуритоз. Соляная кислота и разб. H2SO4 на Т. не действуют, конц. H2SO4 растворяет его, образующиеся красные растворы содержат катион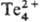 . Разб. HNO3 окисляет Т. до теллуристой кислоты H2TeO3 (соли-теллуриты), концентрированная-до Те2O3 (ОН) NO3. Сильными окислителями (HClO3, KMnO4 и др.) окисляется до теллуровой кислоты H6ТеОб (соли-тел-лураты). Т. раств. в растворах сульфидов и полисульфидов щелочных металлов (с образованием тиотеллуридов и тио-теллуритов), в солянокислых растворах Fed,. Реагирует с растворами солей Ag. В CS2 не растворяется. С Cl2, F2 и Br2 реагирует при комнатной температуре, с I2 — при нагр., сплавляется с S, P (соединений при этом не образует), As (давая As2Te3), с Si (с образованием Si2Te3 и SiTe), с Se (образуя при кристаллизации твердые растворы). С бором и углеродом непосредственно не взаимод., с CO при нагр. образует газообразный нестойкий карбонил ТеСО. При сплавлении с металлами получают теллуриды.
. Разб. HNO3 окисляет Т. до теллуристой кислоты H2TeO3 (соли-теллуриты), концентрированная-до Те2O3 (ОН) NO3. Сильными окислителями (HClO3, KMnO4 и др.) окисляется до теллуровой кислоты H6ТеОб (соли-тел-лураты). Т. раств. в растворах сульфидов и полисульфидов щелочных металлов (с образованием тиотеллуридов и тио-теллуритов), в солянокислых растворах Fed,. Реагирует с растворами солей Ag. В CS2 не растворяется. С Cl2, F2 и Br2 реагирует при комнатной температуре, с I2 — при нагр., сплавляется с S, P (соединений при этом не образует), As (давая As2Te3), с Si (с образованием Si2Te3 и SiTe), с Se (образуя при кристаллизации твердые растворы). С бором и углеродом непосредственно не взаимод., с CO при нагр. образует газообразный нестойкий карбонил ТеСО. При сплавлении с металлами получают теллуриды.
Теллуроводород H2Те — бесцветный газ с неприятным запахом; в жидком состоянии зеленовато-желтый, кристаллический-лимонно-желтый; т. кип. −2 °C, т. пл. −51 °C; плотн. 5,81 г/л; для газа 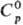 35,6 Дж/(моль∙К),
35,6 Дж/(моль∙К), 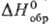 99,7 кДж/моль,
99,7 кДж/моль, 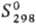 222,8 Дж/(моль∙К); ΔHпл 4,2 кДж/моль,
222,8 Дж/(моль∙К); ΔHпл 4,2 кДж/моль, 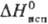 23 кДж/моль; а сухом воздухе при комнатной температуре медленно разлагается, во влажном окисляется до Т.; при нагревании на воздухе горит, давая TeO2; растворимость в воде 0,1 М, водный раствор-слабая кислота, К1 2∙10−3; сильный восстановитель; получают взаимодействием Al2Те3 с соляной кислотой, а также электролизом раствора H2SO4 с теллуровым катодом при 0 °C; применяют для получения Т. высокой чистоты.
23 кДж/моль; а сухом воздухе при комнатной температуре медленно разлагается, во влажном окисляется до Т.; при нагревании на воздухе горит, давая TeO2; растворимость в воде 0,1 М, водный раствор-слабая кислота, К1 2∙10−3; сильный восстановитель; получают взаимодействием Al2Те3 с соляной кислотой, а также электролизом раствора H2SO4 с теллуровым катодом при 0 °C; применяют для получения Т. высокой чистоты.
Гексафторид ТеF6 — бесцветный газ; т. пл. −37,8 °C, т. возг. −38,6 °C; плотн. 10,7 г/л; для газа 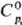 117,6 Дж/(моль∙К),
117,6 Дж/(моль∙К), 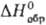 −1318 кДж/моль,
−1318 кДж/моль, 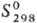 336 Дж/(моль∙К);
336 Дж/(моль∙К); 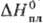 9 кДж/моль,
9 кДж/моль, 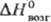 27 кДж/моль; в сухом воздухе устойчив, не действует на стекло; в воде раств., постепенно гидролизу ясь с образованием фторотеллуровых кислот ТеFn(OH)6-n, где n — от 1 до 4, и в конечном счете-теллуровой кислоты; с фторидами металлов образует соед., напр. Ag[TeF7] и Ba[TeF8]; получают фторированием Т. при нагревании. Тстрафторид TeF4-кристаллы ромбич. сингонии; т. пл. 129,6 °C, т. кип. 194 °C (с разл.); плотн. 4,22 г/см3; очень гигроскопичен, легко гидролизуется; с фторидами щелочных металлов образует пентафторотеллураты M[TeF5]; получают действием SeF4 на TeO2. Фториды Т. — фторирующие агенты.
27 кДж/моль; в сухом воздухе устойчив, не действует на стекло; в воде раств., постепенно гидролизу ясь с образованием фторотеллуровых кислот ТеFn(OH)6-n, где n — от 1 до 4, и в конечном счете-теллуровой кислоты; с фторидами металлов образует соед., напр. Ag[TeF7] и Ba[TeF8]; получают фторированием Т. при нагревании. Тстрафторид TeF4-кристаллы ромбич. сингонии; т. пл. 129,6 °C, т. кип. 194 °C (с разл.); плотн. 4,22 г/см3; очень гигроскопичен, легко гидролизуется; с фторидами щелочных металлов образует пентафторотеллураты M[TeF5]; получают действием SeF4 на TeO2. Фториды Т. — фторирующие агенты.
Тетрахлорид ТеCl4-желтые кристаллы; т. пл. 224 °C, т. кип. 381,8 °C; плотн. 3,01 г/см3; уравнение температурной зависимости давления пара gp (мм рт. ст.) = 8,791 — — 3941/T (497 — 653 К); 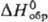 −323,8 кДж/моль,
−323,8 кДж/моль, 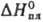 18,9 кДж/моль,
18,9 кДж/моль, 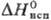 71,1 кДж/моль; очень гигроскопичен, водой гидролизуется; в конц. HCl раств., образуя хлоротел-луровую кислоту H2ТеCl6; из солянокислых растворов экстрагируется трибутилфосфатом и др. орг. растворителями; с хлоридами щелочных металлов образует гекса- М2[ТеCl6] и пентахлортел-лураты М[ТеCl5], с хлоридами Al, Fe(III), Zr и др. — комплексы с катионами
71,1 кДж/моль; очень гигроскопичен, водой гидролизуется; в конц. HCl раств., образуя хлоротел-луровую кислоту H2ТеCl6; из солянокислых растворов экстрагируется трибутилфосфатом и др. орг. растворителями; с хлоридами щелочных металлов образует гекса- М2[ТеCl6] и пентахлортел-лураты М[ТеCl5], с хлоридами Al, Fe(III), Zr и др. — комплексы с катионами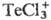 , напр. ТеCl3 [GaCl4]; получают хлорированием Т.; ТеCl4-исходное вещество для получения Т. высокой чистоты. Коричневый дихлорид ТеCl2 устойчив в парах и м. б. сконденсирован в жидкость. Получены также два кристаллич. низших хлорида-серебристо-серый Те2Cl3 и метастабильный черный с металлич. блеском Те2Cl.
, напр. ТеCl3 [GaCl4]; получают хлорированием Т.; ТеCl4-исходное вещество для получения Т. высокой чистоты. Коричневый дихлорид ТеCl2 устойчив в парах и м. б. сконденсирован в жидкость. Получены также два кристаллич. низших хлорида-серебристо-серый Те2Cl3 и метастабильный черный с металлич. блеском Те2Cl.
Осаждением из водных растворов можно получить сульфиды TeS2 и TeS3, разлагающиеся при нагр.; известны TeS7 и Te7S10. Тиотеллураты (напр., Na2TeS3) м. б. получены растворением Т. в растворе полисульфидов щелочных металлов или S — в растворах полителлуридов, а также сплавлением. Тиотеллураты-промежут. продукты в некоторых процессах извлечения Т.
• см. также теллурорганические соединения
Получение. Осн. источники Т. — шламы электролитич. рафинирования Cu и шламы сернокислотного производства, а также щелочные дроссы рафинирования Pb. При переработке сернокислотных шламов методом обжига (см. селен) Т. остается в огарке, который выщелачивают соляной кислотой. Из солянокислого раствора пропусканием SO2 осаждают Se, после чего раствор разбавляют до содержания кислоты 10–12% и при нагр. действием SO2 осаждают Т.
При спекании шламов с содой и послед. выщелачивании Т. переходит в раствор и при нейтрализации осаждается в виде TeO2. Т. получают либо прямым восстановлением TeO2 углем, либо осаждением при действии SO2 на солянокислые растворы TeO2. При переработке шламов сульфидным методом (выщелачивание раствором Na2S) Т. выделяют из раствора (после осаждения Se аэрацией) действием сухого Na2S2O3:
Na2TeS3 + 2Na2SO3 → Те + 2Na2S2O3 + Na2S
При переработке медеэлектролитных шламов Т. в осн. переходит в содовые шлаки, получающиеся при переплавке остатков на золото-серебряный сплав ("металл Дорэ"). При использовании сульфатизации часть Т. переходит в сульфатные растворы вместе с Cu. Из них Т. осаждают действием металлич. Cu:
H2TeO3 + 4H2SO4 + 6Cu → Те + Cu2Те + 4CuSO4 + 6H2O
Из содовых шлаков Т. извлекают после растворения в воде либо нейтрализацией с осаждением TeO2 (его очищают переосаждением из сульфидных или кислых растворов, растворяют в щелочи и выделяют Т. электролизом), либо прямо из содового раствора электролизом осаждают черновой Т. Его восстанавливают А1 в щелочном растворе:
6Те + 2А1 + SNaOH → 3Na2Te2 + 2NaAlO2 + 4H2O Затем Т. осаждают аэрацией:
2Na2Te2 + 2H2O + O2 → 4Те + 4NaOH
Для очистки Т. используют переосаждение из кислых, щелочных или теллуридных растворов. Дополнит. очистка достигается при переплавке порошкообразного Т. с добавкой NaNO3 и др. реагентов. Для получения Т. высокой чистоты используют его летучие соед., в частности ТеCl4, который очищают дистилляцией или ректификацией и экстракцией из солянокислого раствора. После гидролиза хлорида TeO2 восстанавливают H2. Иногда для очистки используют также H2Те. На завершающих стадиях очистки применяют вакуумную сублимацию, дистилляцию или ректификацию Т., а также зонную плавку или направленную кристаллизацию.
Определение. Большинство методов качеств. обнаружения Т. основано на окислительно-восстановит. реакциях. При использовании щелочных растворов станнита, фосфорноватистой кислоты и др. восстановителей получают черный или коричневый осадок, в реакциях с солями Cu и персульфатом Na-красно-коричневый комплекс Cu(II). Из орг. реагентов применяют антразо, который в солянокислой среде с соединениями Т. дает сине-зеленый осадок.
Количественно Т. определяют гравиметрически (с осаждением либо элементарного Т. при действии восстановителей, либо TeO2), титриметрически (чаще других используют тиосульфатный и иодометрич. методы), фотометрич. и флуорометрич. методами (основаны на образовании комплексов с серосодержащими орг. реагентами — висмутолом II, диэтилдитиокарбаматом, тиомочевиной и их производными, а также с орг. основаниями — производными пиразо-лона и родаминовыми красителями). Используют полярографич. и атомно-адсорбционный методы.
Применение. Важнейшая область применения Т.—синтез разл. теллуридов, обладающих полупроводниковыми свойствами. Т. используют также в металлургии для легирования чугуна и стали, Pb, Cu (для повышения их мех. и хим. стойкости). Т. и его соед. применяют в производстве катализаторов, спец. стекол, инсектицидов, гербицидов и т. п.
Мировое производство Т. (без СССР) ок. 220 т/год (1985). Осн. производители-Япония, США и Канада.
Т. в 1782 выделил И. Мюллер, в 1789-П. Китабейль, в 1798 Т. выделил и идентифицировал М. Клапрот.
Т. и в особенности его соед. токсичны. Т. вызывает тошноту, бронхиты, пневмонию и пневмосклероз, нарушения нуклеинового и белкового обмена и др. ПДК Т. в воздухе 0,01 мг/м3, в воде 0,01 мг/л.
Лит.: Чижиков Д. М., Счастливый В. П., Теллур и теллуриды, М., 1966; Сошникова Л. А., Купченко М. М., Переработка медеэлектро-литных шламов, М., 1978. См. также лит. при ст. селен.
П. И. Федоров
Значения в других словарях
- Теллур — (лат. Tellurium) Te, химический элемент VI группы главной подгруппы периодической системы Менделеева; атомный номер 52, атомная масса 127,60, относится к редким рассеянным элементам (См. Рассеянные элементы). Большая советская энциклопедия
- теллур — -а, м. Химический элемент, хрупкий кристаллический металл серебристо-белого цвета. [От лат. tellus, telluris — земля] Малый академический словарь
- теллур — орф. теллур, -а (хим.) Орфографический словарь Лопатина
- теллур — Теллу́р/. Морфемно-орфографический словарь
- ТЕЛЛУР — ТЕЛЛУР (символ Те), серебристо-белый химический элемент, открытый в 1782 г. Встречается в природе в сочетании с золотом в сильваните. Его основной источник — побочный продукт электролитического рафинирования меди. Научно-технический словарь
- Теллур — Te (лат. Tellurium * a. tellurium; н. Tellur; ф. tellure; и. teluro), — хим. элемент VI группы периодич. системы Менделеева, ат. н. 52, ат. м. 127,60. Горная энциклопедия
- теллур — ТЕЛЛУР [тэ], -а; м. [от лат. tellus (telluris) — земля] Химический элемент (Те), хрупкий кристаллический металл серебристо-серого цвета (применяется при изготовлении коричневых красителей, полупроводниковых материалов). ◁ Теллурный, -ая, -ое. Толковый словарь Кузнецова
- теллур — Теллура, мн. нет, м. [от латин. tellus – земля] (хим.). Химический элемент, кристаллическое вещество серебристо-белого цвета. Большой словарь иностранных слов
- ТЕЛЛУР — ТЕЛЛУР (лат. Tellurium) — Те, химический элемент VI группы периодической системы, атомный номер 52, атомная масса 127,60. Название от лат. tellus род. п. telluris — Земля. Большой энциклопедический словарь
- теллур — теллур м. Химический элемент, хрупкий кристаллический металл серебристо-серого цвета. Толковый словарь Ефремовой
- теллур — ТЕЛЛ’УР, теллура, мн. нет, ·муж. (от ·лат. tellus — земля) (·хим. ). Химический элемент, кристаллическое вещество серебристо-белого цвета. Толковый словарь Ушакова
- Теллур — (хим.; Tellur нем., Tellure франц., Tellurium англ.; при О = 16 Те = ок. 126,4 — по Штейнеру, 1901 г., см. ниже) — впервые был замечен Мюллер-фон-Рейхенштейном (1782). Энциклопедический словарь Брокгауза и Ефрона
