тепловая теорема
ТЕПЛОВАЯ ТЕОРЕМА (третье начало термодинамики)
фундаментальное утверждение термодинамики, согласно которому в любых изотермич. процессах, протекающих вблизи абс. нуля температуры, изменения энтропии системы не происходит, т. е. 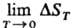 = 0. Энтропия конденсир. фаз при Т:0 не зависит от параметров состояния системы (давления, объема, напряженности магн. поля, поверхностного натяжения на границе раздела фаз и т. п.). Т. т. не является следствием первого и второго начал термодинамики, имеет многочисл. эксперим. подтверждения и наз. третьим началом термодинамики. Впервые сформулирована В. Нернстом в 1906.
= 0. Энтропия конденсир. фаз при Т:0 не зависит от параметров состояния системы (давления, объема, напряженности магн. поля, поверхностного натяжения на границе раздела фаз и т. п.). Т. т. не является следствием первого и второго начал термодинамики, имеет многочисл. эксперим. подтверждения и наз. третьим началом термодинамики. Впервые сформулирована В. Нернстом в 1906.
Важнейшими примерами соотношений, устанавливаемыми Т. т., служат след. равенства:
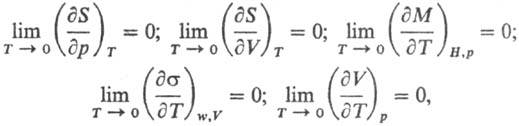
где S — энтропия, p и V-давление и объем фазы, М-общая намагниченность, H-напряженность магн. поля, σ-поверхностное натяжение фазы на границе раздела с газовой (паровой) фазой, w-площадь поверхности фазы. Таким образом, объем, намагниченность, поверхностное натяжение, др. термодинамич. свойства вблизи абс. нуля температуры перестают зависеть от температуры. Т. т. подразумевает, кроме того, что для теплоемкостей вещества при постоянном давлении Cр и при постоянном объеме CV выполняется условие:
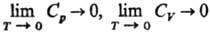
Важно, что эти утверждения м. б. получены теоретически, на основе положений квантовой теории твердого тела.
Т. т. сформулирована для конденсир. фаз, однако это не является существ. ограничением ее применимости, т. к. при температурах, близких к абс. нулю, все известные в природе вещества находятся при конечном давлении в конденсир. состоянии.
Из Т. т. следует утверждение о принципиальной недостижимости абс. нуля температуры в к.-л. реальном процессе перехода с конечным числом операций. Существ. сложность представляют собой т. наз. замороженные фазы-стекла, некоторые мол. кристаллы (СО, NO, N2O и др.). Это неравновесное состояние вещества, сохраняющее ниже температуры плавления структуру, присущую расплавам. Энтропия замороженной фазы больше энтропии равновесной фазы того же состава при той же температуре, причем разница энтропии сохраняется вплоть до абс. нуля температуры. Однако поскольку переход равновесная фаза ⇄ замороженная фаза не относится к превращениям, происходящим между равновесными фазами, противоречия с Т. т. не возникает. Утверждение о невозможности достижения абс. нуля температуры с помощью процессов, в которые вовлечены замороженные фазы, справедливо.
Альтернативная формулировка Т. т. предложена М. Планком (1911). Согласно этой формулировке, при абс. нуле температуры энтропия любой равновесной конденсир. фазы равна нулю при любых значениях параметров состояния, т. е. 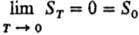 . Формулировка Планка позволяет производить расчеты абс. энтропии веществ в любом агрегатном состоянии. Так, для 1 моля газа А абс. энтропияпри температуре T1 и давлении p определяется по формуле:
. Формулировка Планка позволяет производить расчеты абс. энтропии веществ в любом агрегатном состоянии. Так, для 1 моля газа А абс. энтропияпри температуре T1 и давлении p определяется по формуле:
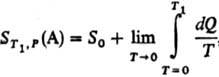
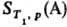
где S0 = 0-энтропия конденсир. вещества А при абс. нуле температуры, 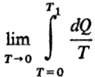 -теплота, подведенная к системе для нагревания до температуры T1 и перевода вещества А в газ, которая м. б. измерена калориметрически.
-теплота, подведенная к системе для нагревания до температуры T1 и перевода вещества А в газ, которая м. б. измерена калориметрически.
Абс. энтропии приводятся в справочниках термодинамич. величин (см. энтропия). Знание абс. энтропии помогает рассчитывать условия хим. равновесия (т. наз. метод абс. энтропии; см. константа равновесия).
Формулировка Планка м. б. проверена путем сравнения результатов калориметрич. измерений и статистич. расчетов энтропии для газов. Для исследованных к настоящему времени веществ показано, что
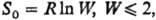
где R — газовая постоянная, W-термодинамич. вероятность, равная числу микросостояний системы, реализующих данное макросостояние (см. статистическая термодинамика).
Лит. см. при статьях термодинамические потенциалы, химическая термодинамика.
М. В. Коробов
