тетрафторэтилен
ТЕТРАФТОРЭТИЛЕН (перфторэтилен, мономер М-4) CF2=CF2
мол. м. 100,02; бесцветный газ без запаха; т. пл. −131,15 °C, т. кип. −76,3 °C; 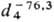 1,519; tкрит 33,3 °C, pкрит 3,95 МПа, dкрит 0,572 г/см3; давление пара (МПа): 0,0822 ( −80 °C), 1,004 ( −20 °C), 1,776 (0 °C), 2,928 (20 °C), 3,691 (30 °C); ΔHисп 16,53 кДж/моль (при −76,3 °C), −659,5 кДж/моль; растворимость в воде 0,018% по
1,519; tкрит 33,3 °C, pкрит 3,95 МПа, dкрит 0,572 г/см3; давление пара (МПа): 0,0822 ( −80 °C), 1,004 ( −20 °C), 1,776 (0 °C), 2,928 (20 °C), 3,691 (30 °C); ΔHисп 16,53 кДж/моль (при −76,3 °C), −659,5 кДж/моль; растворимость в воде 0,018% по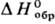 массе (20 °C), в тетрафтордибромэтане 10,7% ( −20 °C) и 2,7 (20 °C).
массе (20 °C), в тетрафтордибромэтане 10,7% ( −20 °C) и 2,7 (20 °C).
По химическим свойствам — типичный фторолефин. В атмосфере O2 разлагается до CO2 и CF4, при 200 °C начинается термич. разложение, при 600–800 °C образуются продукты внедрения дифторкарбена и димеризации:
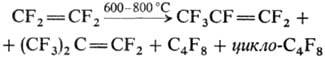
В контролируемых условиях (O2, УФ облучение) окисляется до малостабильного тетрафторэтиленоксида; последний легко превращ. в олигомерные перфторполи-эфиры:
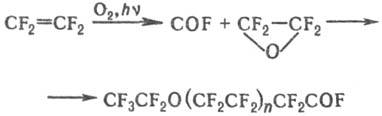
В присут. источников аниона F− в апротонных полярных растворителях образует реакционноспособный пентафторэтильный анион, который легко подвергается дальнейшим превращениям:
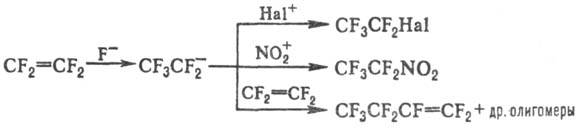
Т. реагирует с олефинами с образованием циклических и линейных продуктов; с нитрозоалканами образует, как правило, смесь оксазетидинов и линейных сополимеров:
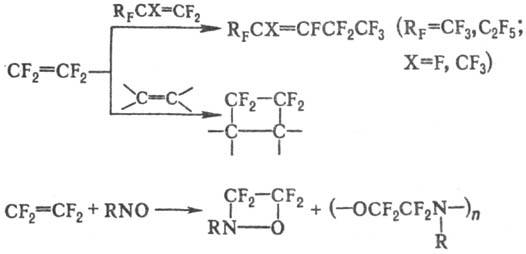 '
'
Взаимодействие Т. с перфторбром- и перфториодалка-нами, перфтордиалкилдисульфидами, пероксисульфурил-фторидом и др. приводит к соответствующим теломерам, напр.:
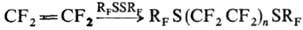
RF — перфторалкил
Полимеризация и сополимеризация Т. приводит к хемо- и термостойким полимерам.
В промышленности Т. получают пиролизом CF2HCl при 700–800 °C. Др. способы: пиролиз политетрафторэтилена, перфторциклобутана, трифторметана или др. фторорг. соед.; высокотемпературное гидрирование CF2ClCF2Cl или CF2Cl2; дегалогенирование тетрафтордихлор(дибром)этана с помощью металлов; декарбоксилирование солей пер-фторпропионовой кислоты.
Применяют Т. для получения разл. полимеров (напр., тефлона) и сополимеров (напр., с этиленом, гексафторпро-пиленом, нитрозоперфторалканами и др. олефинами), инертных тяжелых жидкостей и смазок, а также ряда фторорг. соединений.
При вдыхании Т. поражает слизистые оболочки верх. дыхат. путей и легочной ткани, вызывает функцион. расстройства центр. нервной системы. ПДК рабочей зоны производств. помещений 30 мг/м3, макс. разовая ПДК в воздухе населенных мест 6 мг/м 3 (класс опасности 4).
Т. — горючий и взрывоопасный газ. При соприкосновении с открытым пламенем или нагретыми поверхностями разлагается с образованием высокотоксичных продуктов. КПВ 13,4–46,4% по объему. При хранении в жидкой фазе способен к спонтанной взрывообразной полимеризации.
Лит.: Рахимов А. И., Химия и технология фторорганических соединений, М., 1986; Промышленные фторорганические продукты. Справочник, Л., 1990.
И. И. Крылов
Значения в других словарях
- Тетрафторэтилен — Перфторэтилен, CF2 = CF2, газ без цвета и запаха, не растворяется в воде, растворяется в органических растворителях; tкип -76,3 °С. Обладает всеми свойствами, характерными для фторолефинов (см. Большая советская энциклопедия
- тетрафторэтилен — орф. тетрафторэтилен, -а Орфографический словарь Лопатина
- ТЕТРАФТОРЭТИЛЕН — ТЕТРАФТОРЭТИЛЕН (перфторэтилен) — F2C=CF2, бесцветный газ, tкип -76,3 °С. Сырье в производстве политетрафторэтилена и фторкаучуков. Большой энциклопедический словарь
