тиоацетамид
ТИОАЦЕТАМИД (амид тиоуксусной кислоты) CH3C(S)NH2
мол. м. 75,13; бесцветные кристаллы с очень слабым запахом; т. пл. 111–114 °C; длины связей (нм) 0,173 (C=S), 0,132 (С—N), углы CCS 120,7 °, SCN 117,7 °, HNC 117°, HNH 123 °; μ 15,9∙10−30 Кл∙м; хорошо раств. в воде, этаноле, плохо — в диэтиловом эфире и бензоле.
Ранее предполагалось наличие равновесия между тио-амидной и тиолимидной формами Т.: CH3C(S)NH2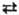 CH3C(=NH)SH. Однако, по совр. данным, измеримые концентрации тиолимидной формы отсутствуют.
CH3C(=NH)SH. Однако, по совр. данным, измеримые концентрации тиолимидной формы отсутствуют.
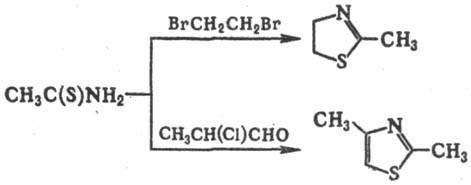
В водных растворах Т. гидролизуется медленно, в кислых или щелочных-быстро: CH3C(S)NH2 + 2H2O → CH3COONH4 + H2S. С минеральными кислотами Т. образует соли, с солями тяжелых металлов-комплексные соед., при кипячении с пиридином-ацетонитрил, с алкилгалогенидами — N-алкилзаме-щенные Т. Взаимодействие Т. с 1,2-дигалогеналканами приводит к 2-метилтиазолинам, с α-галогенальдегидами или α-галогенкетонами — к соответствующим 2-метилтиазолам, напр.:
Реакция Т. с нитрилами алифатич. и ароматич. карбоновых кислот — общий метод синтеза тиоамидов карбоновых кислот; при удалении низкокипящего ацетонитрила равновесие необратимо сдвигается вправо:
RCN + CH3C(S)NH2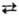 [RC(=NH)SC(=NH)CH3] : : RC(S)NH2 + CH3CN
[RC(=NH)SC(=NH)CH3] : : RC(S)NH2 + CH3CN
Получают Т. нагреванием ацетамида CH3CONH2 с P2S5 в бензоле, взаимод. ацетонитрила CH3CN с H2S в присутствии SiO2/Al2O3 при 255–260 °C и реакцией ацетата аммония с Na2S при 240 °C.
Водный раствор Т. используют в аналит. химии как заменитель сероводорода (метод возникающих реагентов). Т. — групповой реагент для гравиметрич. определение As, В, Cd, Со, Cu, Fe, Hg, Mn, Mo, Ni, Pb, Sb, Sn, Zn; фотометрич. определения малых количеств тяжелых металлов (напр., Pb, Cu) в солях щелочных металлов; стабилизатор при получении полисульфидных смол.
Т. токсичен, поражает печень и почки; канцероген; ЛД50 0,2 г/кг.
Лит.: Физер Л., Физер М., Реагенты для органического синтеза, пер. с англ., т. 7, М., 1978, с. 498.
А. А. Дудшюв
