тиогликолевая кислота
ТИОГЛИКОЛЕВАЯ КИСЛОТА (меркаптоуксусная кислота) HSCH2COOH
мол. м. 92,11; бесцветная жидкость с сильным неприятным запахом; т. пл. −16,5 °C, т. кип. 123 °C/29 мм рт. ст., 90 °C/6 мм рт. ст.; 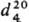 1,3253;
1,3253; 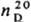 1,5030;
1,5030; 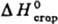 −1446 кДж/моль; pKa1 3,55–3,92, рKа2 9,20–10,56. Смешивается во всех соотношениях с водой, метанолом, этанолом, ацетоном, диэтиловым эфиром, хлороформом, бензолом. Практически не раств. в алифатич. углеводородах.
−1446 кДж/моль; pKa1 3,55–3,92, рKа2 9,20–10,56. Смешивается во всех соотношениях с водой, метанолом, этанолом, ацетоном, диэтиловым эфиром, хлороформом, бензолом. Практически не раств. в алифатич. углеводородах.
В водных растворах с концентрацией ниже 70% Т. к. стабильна при 20 °C, в более конц. растворах и при повышенной температуре происходит самоэтерификация с образованием S-меркаптоацетилтиоуксусной кислоты HSCH2qO)SCH2COOH, циклич. 1,4-дитиогликолида и политиогликолидов.
Для Т.к. характерны свойства карбоновых кислот и тиолов (образование солей, сложных эфиров, амидов, тиолятов, сульфидов, дисульфидов). Обратимо взаимод. с дисульфидами, напр. цистином (скорость, при которой устанавливается равновесие, мала при pH < 6 и велика при pH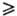 8 — 10):
8 — 10):
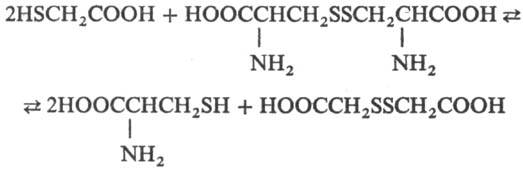
На этой реакции основано использование Т. к. для хим. завивки волос (производные Т. к. — аммониевая соль, соль моно-этаноламина, моноглицериновый эфир-разрушают связи S—S цистина в кератине волос, под действием окислителей эти связи снова образуются).
Т.к. легко окисляется (особенно в щелочных растворах) в присутствии солей Cu, Mn или Fe до дитиодигликолевой кислоты (HOOCCH2S)2 либо ее солей; сильные окислители (напр., разб. HNO3) превращают Т.к. в сульфоуксусную кислоту HSO3CH2COOH.
Т. к. замещает атом H тиольной группы в реакциях с алкил-галогенидами, алкилендигалогенидами, хлоруксусной кислотой, ацетилхлоридом в присутствии щелочей; присоединяется к непредельным соед.; с альдегидами и кетонами (при соотношении 1:2) образует тиоацетали RR'C(SCH2COOH)2.
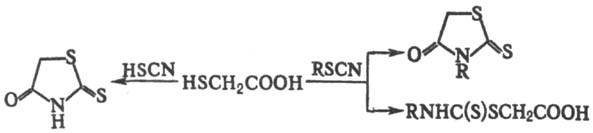
Взаимодействие Т.к. с тиоциановой кислотой приводит к 2-тионо-1,3-тиазолидин-4-ону (роданину); с N-замещенными изотиоцианатами при pH 3,0–7,5 — к N-замещенным родани-нам, при pH>9,5 — к N-замещенным тиокарбамоилтио-гликолевой кислоты:
Получают Т. к. обработкой К- или Na-соли хлоруксусной кислоты гидросульфидами щелочных металлов в водной среде; побочно образуются гликолевая, тио- и дитиодигликолевые кислоты. Во избежание образования побочных продуктов м. б. использованы др. соединения S, напр. Na2S2O3, полисульфиды щелочных металлов, тиомочевина, тритиокарбонат Na, напр.:
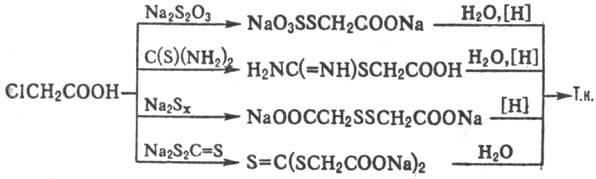
Для качеств. определения Т.к. используют нитропруссид Na в аммиачном растворе, образующий с Т.к. фиолетово-пурпурную окраску, для количественного-иодометрич. титрование.
Композиции эфиров Т.к. и оловоорг. соединений применяют для стабилизации ПВХ, тиогликоляты используют в качестве добавок, регулирующих мол. массу продуктов полимеризации акрилонитрила и метилметакрилата. Т.к. применяют также как добавку к фиксирующим растворам в фотографии для предотвращения выделения серебра на стенках ванн, при травлении для снижения коррозии металла, для растворения и удаления лигнина из древесины, что обусловлено способностью Т. к. расщеплять полифенольные материалы, напр. таннины и лигнин. В сочетании с красителями, реагирующими с группами HS, Т. к. применяют для окраски волос, кремы на основе Na- или Са-солей Т. к. с pH 10,0–12,5 используют в качестве депиляторов.
Т. воспл. > 110 °C, ПДК 0,1 мг/м3, ЛД50 250–300 мг/кг (мыши, перорально) и 120–150 мг/кг (крысы, перорально).
Лит.: Kirk-Othmer encyclopedia, 3 ed, v. 22, N. Y., 1983, ρ. 933–46.
А. А. Дудинов
