валентных связей метод
ВАЛЕНТНЫХ СВЯЗЕЙ МЕТОД (метод валентных схем)
метод приближенного решения электронного уравнения Шрёдингера для многоэлектронных молекулярных систем. Основан на представлениях о двухцентровых хим. связях между атомами в молекуле, образуемых двумя электронами. Эти представления являются обобщением на многоатомные молекулы приближения Гайтлера — Лондона, позволившего впервые с помощью квантовомех. методов объяснить хим. связь в молекуле H2.
Осн. физ. идея В. с. м. состоит в том, что волновая функция молекулы выражается через волновые функции составляющих ее атомов. Образование хим. связи рассматривается как результат спаривания спинов своб. электронов атомов. Тем самым В. с. м. дает обоснование одному из осн. положений теории валентности: валентность нейтрального атома равна числу своб. электронов в его валентной оболочке. Каждому валентному штриху, соединяющему атомы А и В в структурной формуле молекулы, отвечает двухэлектронная функция валентной связи ХАВ(1,2), которая представляется в виде произведения двух волновых функций: пространственной Ф(1,2), симметричной относительно перестановки координат электронов, и спиновой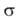 (1,2), антисимметричной относительно такой перестановки и описывающей систему двух электронов с противоположными спинами; цифры 1 и 2 в этих обозначениях указывают пространств. координаты или спиновые переменные первого и второго электронов либо те и другие одновременно. Следовательно,
(1,2), антисимметричной относительно такой перестановки и описывающей систему двух электронов с противоположными спинами; цифры 1 и 2 в этих обозначениях указывают пространств. координаты или спиновые переменные первого и второго электронов либо те и другие одновременно. Следовательно,
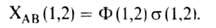
Для простейшей молекулы H2 функцию Ф(1,2) строят из 1s-орбиталей атомов Н, обозначаемых для разных ядер как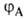 и
и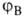 , а функциюσ(1,2) — из одноэлектронных спиновых функций
, а функциюσ(1,2) — из одноэлектронных спиновых функций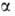 и
и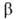 (спин-функций), описывающих состояния электронов с противоположно направленными спинами:
(спин-функций), описывающих состояния электронов с противоположно направленными спинами:
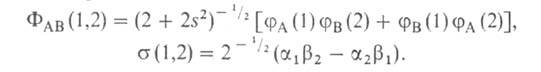
Энергия молекулы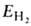 , рассчитанная с такой двухэлектронной волновой функцией Х(1,2), равна:
, рассчитанная с такой двухэлектронной волновой функцией Х(1,2), равна:
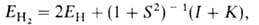
где ЕH-энергия атома Н, 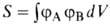 — интеграл перекрывания орбиталей (dV- элемент объема в пространстве координат одного электрона), I и К — т. наз. кулоновский и обменный интегралы соответственно. Кулоновский интеграл учитывает вклад в энергию связи, обусловленный электростатич. взаимод. неискаженных электронных облаков атомов между собой и с ядром соседнего атома, обменный — вклад, обусловленный деформацией электронного облака при образовании связи и перемещением его в пространство между ядрами (> 90% энергии связи); см. также молекулярные интегралы.
— интеграл перекрывания орбиталей (dV- элемент объема в пространстве координат одного электрона), I и К — т. наз. кулоновский и обменный интегралы соответственно. Кулоновский интеграл учитывает вклад в энергию связи, обусловленный электростатич. взаимод. неискаженных электронных облаков атомов между собой и с ядром соседнего атома, обменный — вклад, обусловленный деформацией электронного облака при образовании связи и перемещением его в пространство между ядрами (> 90% энергии связи); см. также молекулярные интегралы.
Для более сложных молекул многоэлектронную волновую функцию представляют в виде антисимметризированного в соответствии с принципом Паули произведения всех двухэлектронных функций типа ХАВ(1,2) и функций, описывающих состояние электронов внутр. оболочек, неподеленных электронных пар и неспаренных электронов, не занятых в двухцентровых связях. Отвечающее этой функции распределение "валентных" штрихов, соединяющих атомы в молекуле, наз. валентной схемой. Такой подход наз. приближением идеального спаривания или приближением локализованных электронных пар. Электроны соотносят отдельным атомам и в соответствии с осн. идеей приближения Гайтлера — Лондона их состояния описывают атомными орбиталями. Согласно вариационному принципу (см. вариационный метод), приближенную волновую функцию выбирают так, чтобы она давала миним. электронную энергию системы или, соответственно, наиб. значение энергии связи. Это условие, вообще говоря, достигается при наиб. перекрывании орбиталей, принадлежащих одной связи. Тем самым В. с. м. дает обоснование критерия макс. перекрывания орбиталей в теории направленных валентностей. Лучшему перекрыванию орбиталей, отвечающих данной валентной связи, способствует гибридизация атомных орбиталей, т. е. участие в связи не "чистых" s-, p-или d-орбиталей, а их линейных комбинаций, локализованных вдоль направлений хим. связей, образуемых данным атомом.
Внутриатомные вклады в энергию молекулы, аналогичные ЕН, обычно превышают энергию своб. атомов на величину, называемую энергией промотирования. Такое превышение обусловлено электронной перестройкой атома при переходе его в валентное состояние, т. е. в состояние, требуемое для образования хим. связей, а именно: переходом электронов на энергетически менее выгодные атомные орбитали (напр., с 2s на 2р) при распаривании электронов, переходом от наиб. выгодных орбиталей в своб. атоме к менее выгодным гибридным орбиталям. Образование хим. связи объясняется тем, что выигрыш в энергии связи компенсирует затраты энергии на промотирование атомов.
Дальнейшее уточнение описания молекулярных систем в рамках В. с. м. связано с использованием линейных комбинаций волновых функций неск. валентных схем. Такой подход обычно и наз. методом валентных схем. Коэффициенты в линейной комбинации функций, отвечающих в приближении идеального спаривания разл. валентным схемам, возможным для данной молекулы, определяют вариационным методом. К валентным схемам относятся все схемы ковалентных (т. наз. кекулевских) структур с максимально возможным числом валентных связей между соседними атомами, т. наз. дьюаровских структур с "длинными" связями, в которых формально спарены электроны, принадлежащие несоседним атомам, а также структур ионного типа, в которых электрон формально перенесен от одного атома к другому. На этом основании В. с. м. нередко рассматривают как мат. обоснование теории резонанса. Один из простых способов построения всех валентных схем дается правилами Румера: каждой однократно занятой орбитали ставят в соответствие точку на некоторой окружности, каждому спариванию электронов — стрелку, соединяющую две такие точки. Полученную диаграмму наз. диаграммой Румера. При построении полной волновой функции молекулы учитывают все диаграммы Румера с непересекающимися стрелками. Диаграммы Румера дают удобный графич. метод вычисления матричных элементов гамильтониана на функциях валентных схем через кулоновские, обменные и др. интегралы. В полуэмпирич. вариантах В. с. м. кулоновские и обменные интегралы рассматривают как параметры, определяемые из спектроскопич. и термохим. данных, в неэмпирич. вариантах все молекулярные интегралы точно рассчитывают (см. полуэмпирические методы, неэмпирические методы).
Последоват. увеличение числа базисных атомных орбиталей и включение в расчет все большего числа валентных схем и электронных конфигураций позволяют получать практически точное неэмпирич. решение уравнения Шрёдингера.
Достоинства В. с. м. — наглядность качеств. описания молекул с локализованными связями, непосредств. аналогия между валентными схемами и структурными формулами, возможность объяснения многих эмпирич. аддитивных закономерностей в химии. Однако этому методу часто предпочитают более простые по своей структуре молекулярных орбиталей методы.
Лит.: Пикок Т., .Электронные свойства ароматических и гетероциклических молекул, пер. с англ., М., 1969; Мак-Вини Р., Сатклиф Б., Квантовая механика молекул, пер. с англ., М., 1971
А. А. Багатурьянц
