валериановые кислоты
ВАЛЕРИАНОВЫЕ КИСЛОТЫ C4H9COOH
мол. м. 102,13. В статье рассмотрены кислоты, содержащие бутильный остаток, связанный с группой СООН.
Валериановая (пентановая) кислота CH3(CH2)3COOH (В.к.) — бесцветная жидкость; т. пл. −34,5 °C, т. кип. 185,4 °C, 93,5–94 °C/21 мм рт. ст.; d420 0,9459, nD20 1,41.00; η 2,359 мПа∙с (15 °C); ΔH0обр −548,9 кДж/моль, 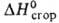 −2853,4 кДж/моль; К 1,147∙10−5 (20 °C); растворимость в воде 4,97% (25 °C). Образует бинарные азеотропные смеси с многими веществами, напр. с бромбензолом (3,5% В.к.; т. кип. 155,6 °C). Соли и эфиры В. к. наз. валератами. Содержится в продуктах перегонки древесины, бурого угля и др. В промышленности получают гидроформилированием 1-бутена с послед. окислением образующегося альдегида; окислением амилового спирта. Наряду с бутилвалератом получается при обработке бутанола CO в присутствии NiI2 и Nal или никеля Ренея в водном растворе при 340 °C и 37,5 МПа. Эфиры В. к., обладающие фруктовым и цветочным запахом (напр., изомилвалерат), — ароматизирующие вещества для пищ. продуктов, душистые вещества в парфюмерии; используют также как растворители, сырье в производстве лек. веществ.
−2853,4 кДж/моль; К 1,147∙10−5 (20 °C); растворимость в воде 4,97% (25 °C). Образует бинарные азеотропные смеси с многими веществами, напр. с бромбензолом (3,5% В.к.; т. кип. 155,6 °C). Соли и эфиры В. к. наз. валератами. Содержится в продуктах перегонки древесины, бурого угля и др. В промышленности получают гидроформилированием 1-бутена с послед. окислением образующегося альдегида; окислением амилового спирта. Наряду с бутилвалератом получается при обработке бутанола CO в присутствии NiI2 и Nal или никеля Ренея в водном растворе при 340 °C и 37,5 МПа. Эфиры В. к., обладающие фруктовым и цветочным запахом (напр., изомилвалерат), — ароматизирующие вещества для пищ. продуктов, душистые вещества в парфюмерии; используют также как растворители, сырье в производстве лек. веществ.
Изовалериановая (3-метилбутановая, (5-метилмасляная) кислота (CH3)2CHCH2COOH (И.к.) — бесцветная жидкость; т. пл. −29,3 °C, т. кип. 176,5 °C, 99,5 °C/37 мм рт. ст.; d415 0,9308, nD15 1,4030; 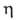 2,731 МПа∙с (15 °C);
2,731 МПа∙с (15 °C); 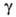 0,024 Н/м (30 °C); μ 3,03∙10−30 Кл∙м;
0,024 Н/м (30 °C); μ 3,03∙10−30 Кл∙м; 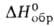 −561,5 кДж/моль,
−561,5 кДж/моль, 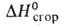 −2840,8 кДж/моль; К 1,216∙10−5 (60 °C); раств. в воде (4,2 г в 100 мл), этаноле, эфире, хлороформе. Соли и эфиры И.к. наз. изовалератами, напр. этилизовалерат (т. пл. 134,1 °C; d420 0,8656, nD20 1,3692; растворимость в воде 0,17%; содержится в ананасах), изоамилизовалерат (жидкость; т. кип. 73–76 °C/14 мм рт. ст.; d420 0,8812, nD20 1,4108; в воде раств. плохо).
−2840,8 кДж/моль; К 1,216∙10−5 (60 °C); раств. в воде (4,2 г в 100 мл), этаноле, эфире, хлороформе. Соли и эфиры И.к. наз. изовалератами, напр. этилизовалерат (т. пл. 134,1 °C; d420 0,8656, nD20 1,3692; растворимость в воде 0,17%; содержится в ананасах), изоамилизовалерат (жидкость; т. кип. 73–76 °C/14 мм рт. ст.; d420 0,8812, nD20 1,4108; в воде раств. плохо).
И.к. содержится в корне валерианы лекарственной, из которого ее и получают отгонкой с водяным паром, а также в чайном листе, эфирных маслах некоторых цитрусовых и др. Синтезируют ее окислением изоамилового спирта, напр.: электролитич. способом в растворе H2SO4 с добавкой MnSO4 на аноде, изготовленном из PbO2, при 20 °C; при нагр. на воздухе с NaOH + KOH (в соотношении 2:1) и небольшим количеством H2O при 285–295 °C или с NaOH в присутствии основного карбоната меди CuCO3*Cu(OH)2*0,5H2O при 140 °C. Вместе с пивалиновой кислотой получается карбонилированием изобутилена при 250 °C и 20 МПа [кат. — Ni(CO)4 и NiI2]. И.к. применяют в производстве валидола, бромизовала, корвалола, валокордина и др. лек. веществ, фруктовых эссенций и душистых веществ в парфюмерии.
Метилэтилуксусная (2-метилбутановая, α-метилмасляная) кислота CH3CH2CH(CH3)СООН (М.к.) — бесцветная жидкость, оптически активна. (+)-Изомер-т. кип. 86,5–87,5 °C/26 мм рт. ст.;d425 0,9313, nD20 1,4058; 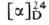 + 35,56° (неразбавленная кислота). Получают (+ ) — M. к. расщеплением рацемата с помощью цинхонидина. Содержится в эфирных маслах, напр. лавандовом. (-)-Изомер — т. кип. 71–72 °C/12 мм рт. ст., 64 °C/2 мм рт. ст; d425 0,9340, nD25 1,4038;
+ 35,56° (неразбавленная кислота). Получают (+ ) — M. к. расщеплением рацемата с помощью цинхонидина. Содержится в эфирных маслах, напр. лавандовом. (-)-Изомер — т. кип. 71–72 °C/12 мм рт. ст., 64 °C/2 мм рт. ст; d425 0,9340, nD25 1,4038; 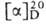 —24° (водный раствор; концентрация 0,9 мг/л). Синтезируют (—) — М. к. окислением 2-метил-1-бутанола действием KMnO4 в водно-щелочном растворе или K2Cr2O7 в среде H2SO4. При окислении (— )-изомера М. к. действием KMnO4 в водно-щелочном растворе получается 2-гидрокси-2-метилмасляная кислота. Рацемат М. к.-т. пл. −48 °C, т. кип. 176,5 °C, 88 °C/20 мм рт. ст.; d420 0,9361, nD20 1,4060;
—24° (водный раствор; концентрация 0,9 мг/л). Синтезируют (—) — М. к. окислением 2-метил-1-бутанола действием KMnO4 в водно-щелочном растворе или K2Cr2O7 в среде H2SO4. При окислении (— )-изомера М. к. действием KMnO4 в водно-щелочном растворе получается 2-гидрокси-2-метилмасляная кислота. Рацемат М. к.-т. пл. −48 °C, т. кип. 176,5 °C, 88 °C/20 мм рт. ст.; d420 0,9361, nD20 1,4060; 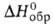 −557,3 кДж/моль,
−557,3 кДж/моль, 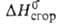 -2845 кДж/моль. Синтезируют декарбоксилированием метилэтилмалоновой кислоты, карбонилированием втор-бутанола действием Ni(CO)4 в присутствии NiCl2 и соляной кислоты при 300 °C и 4 МПа или пропусканием смеси втор-бутанола и CO над NiI2 на силикагеле при 230 °C и 21 МПа, а также гидрокарбонилированием 1-бутена в разб. уксусной кислоте в присутствии Ni(CO)4 (при этом образуется и валериановая кислота). Применяется рацемич. М.к. в производстве пластификаторов, синтетич. смазок, лек. веществ, как экстрагент меркаптанов из углеводородов и стабилизатор виниловых полимеров.
-2845 кДж/моль. Синтезируют декарбоксилированием метилэтилмалоновой кислоты, карбонилированием втор-бутанола действием Ni(CO)4 в присутствии NiCl2 и соляной кислоты при 300 °C и 4 МПа или пропусканием смеси втор-бутанола и CO над NiI2 на силикагеле при 230 °C и 21 МПа, а также гидрокарбонилированием 1-бутена в разб. уксусной кислоте в присутствии Ni(CO)4 (при этом образуется и валериановая кислота). Применяется рацемич. М.к. в производстве пластификаторов, синтетич. смазок, лек. веществ, как экстрагент меркаптанов из углеводородов и стабилизатор виниловых полимеров.
Пивалиновая (триметилуксусная, неопентановая) кислота (CH3)3ССООН (П.к.) — т. пл. 35,7 °C, т. кип. 164,15 °C, 77–78 °C/20 мм рт. ст.; d2040 0,905, nD25 1,4030; 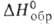 −565,7 кДж/моль,
−565,7 кДж/моль, 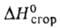 −2836,6 кДж/моль; μ 5,7∙10−30 Кл∙м; К 0,732∙10−5 (60 °C); растворимость в 100 г воды 2,2 г (20 °C). Реакции П. к. осложнены стерич. препятствиями, связанными с экранированием карбоксильной группы CH3-группами. Например, П. к. труднее этерифицируется, чем другие В.к.; эфиры ее более устойчивы при гидролизе и окислении. При окислении H2O2 в присутствии FeSO4 в водном растворе H2SO4 П. к. превращается в 2,2,5,5-тетраметиладипиновую кислоту HOOCC(CH3)2CH2CH2С(CH3)2COOH, хлорируется при облучении УФ-светом (
−2836,6 кДж/моль; μ 5,7∙10−30 Кл∙м; К 0,732∙10−5 (60 °C); растворимость в 100 г воды 2,2 г (20 °C). Реакции П. к. осложнены стерич. препятствиями, связанными с экранированием карбоксильной группы CH3-группами. Например, П. к. труднее этерифицируется, чем другие В.к.; эфиры ее более устойчивы при гидролизе и окислении. При окислении H2O2 в присутствии FeSO4 в водном растворе H2SO4 П. к. превращается в 2,2,5,5-тетраметиладипиновую кислоту HOOCC(CH3)2CH2CH2С(CH3)2COOH, хлорируется при облучении УФ-светом (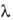 = 365,5 нм) в 3-хлор-2,2-диметилпропионовую кислоту ClCH2С(CH3)2COOH, при взаимодействии с PCl3, PCl5, SOCl2 или COCl2 образуется пивалоилхлорид. Соли и эфиры П. к. наз. пивалатами, напр. этилпивалат (т. пл. 89,5 °C, т. кип. 119 °C).
= 365,5 нм) в 3-хлор-2,2-диметилпропионовую кислоту ClCH2С(CH3)2COOH, при взаимодействии с PCl3, PCl5, SOCl2 или COCl2 образуется пивалоилхлорид. Соли и эфиры П. к. наз. пивалатами, напр. этилпивалат (т. пл. 89,5 °C, т. кип. 119 °C).
В промышленности П. к. получают карбонилированием изобутилена в присутствии HF и H2O при 40–60 °C и 5 МПа; выход 95%. С хорошими выходами м. б. синтезирована таким же способом из бутанола или трет-бутанола (кат. — НВF4*H2O) в среде H2SO4. П. к. применяют в производстве лек. веществ, теплостойких смазок, гербицидов и аттрактантов; кислота и ее Li-соль повышают октановое число моторных топлив. Для защиты древесины м. б. использован пивалат Sn. Эфиры П. к. с бутиловыми спиртами — ароматизирующие вещества для пищ. продуктов (фруктовый, цветочный или винный запах), эфиры с полиолами-пластификаторы.
Лит.: Ullmans Encyklopadie, 4 Aufl., Bd9,Weinheim, 1975, S. 142-44: Kirk-Othmer encyclopedia, 3 ed., v. 4, N. Y.-[a.o.J, 1978, p. 864–71.
И. В. Хвостов
Значения в других словарях
- Валериановые кислоты — Одноосновные насыщенные органические кислоты общей формулы C4H9COOH; бесцветные жидкости с характерным запахом. В зависимости от строения углеводородного радикала возможны четыре изомерные В. к.; их свойства приведены в таблице. Большая советская энциклопедия
