ванадий
ВАНАДИЙ (от имени др.-сканд. богини красоты Ванадис, Vanadis; лат. Vanadium) V
хим. элемент V гр. периодической системы, ат. н. 23, ат. м. 50,9415. Прир. В. состоит из стабильного изотопа 51V (99,76%) и слабо радиоактивного 50V (T1/2 1014 лет). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 4,98∙10−28 м2. Конфигурация внеш. электронной оболочки 3d34s2; степень окисления от + 2 до +5; энергия (эВ) ионизации при последоват. переходе от Vo к V5+ соотв. 6,74, 14,65, 29,31, 48,4, 65,2; электроотрицательность по Полингу 1,6; атомный радиус 0,134 нм, ионные радиусы (в скобках — координац. числа В.): V2+ 0,093 нм (6), V3+ 0,078 нм (6), V4+ 0,067 (5), 0,072 (6) и 0,086 нм (8), V5+ 0,050 (4), 0,060 (5) и 0,068 нм (6). Содержание В. в земной коре 1,9∙10−2 % по массе (в почве — 1,0∙10−2%), в воде океанов — 3∙10−7%, золе растений — 6,1∙10−3 %. Относится к рассеянным элементам. В своб. виде в природе не встречается. Важнейшие минералы: патронит V(S2)2, ванадинит Pb5(VO4)3Cl, деклуазит Pb(Zn, Cu)(VO4)(OH), моттрамит 5(Cu, Pb)O*V2O5*2H2O, тюямунит Ca(UO2)2(VO4)2*8H,O, карнотит K2(UO2)2(VO4)2*3H2O, роскоэлит KV2 [AlSi3O10](OH)2. В некоторых магнетитовых, титаномагнетитовых и осадочных железных рудах и ванадийсодержащих фосфоритах содержится до 2,5–3,0% V2O5. В. также присутствует в окисленных медно-свинцово-цинковых рудах (в виде минералов), высокосернистых нефтях (до 300 г в 1т), битуминозных сланцах, асфальтитах. Мировые запасы В. (без СССР) — 42 млн. т.
Свойства. В. — серебристо-серый металл; кристаллич. решетка кубич. объемноцентрированная, а = 0,3024 нм, z = 2, пространственная группа Im3m. Т. пл. 1920 °C, т. кип. 3400 °C; плотн. 6,11 г/см3; C0p 24,95 Дж/(моль∙К); 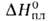 23,05 кДж/моль,
23,05 кДж/моль, 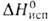 474 кДж/моль (1900 °C); S0298 28,9 Дж/(моль∙К); уравнение температурной зависимости давления пара 1gр( мм рт. ст.) = — 26650/Т — 0,112∙10−3Т + 10,815 (293 — 2173 К); температурный коэф. линейного расширения 8,98∙10−6 К−1; теплопроводность 1,0 Вт/(м∙К) (293 К);
474 кДж/моль (1900 °C); S0298 28,9 Дж/(моль∙К); уравнение температурной зависимости давления пара 1gр( мм рт. ст.) = — 26650/Т — 0,112∙10−3Т + 10,815 (293 — 2173 К); температурный коэф. линейного расширения 8,98∙10−6 К−1; теплопроводность 1,0 Вт/(м∙К) (293 К); 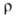 образца после холодной деформации 24,8∙10−8 Ом∙м, температурный коэф.
образца после холодной деформации 24,8∙10−8 Ом∙м, температурный коэф.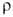 3,4∙10−3 К−1 (273–373 К). В. парамагнитен, магн. восприимчивость массивного образца 5,48∙10−9. Стандартный электродный потенциал V2+/V° — 1,50 В. Температура перехода в сверхпроводящее состояние ниже 5,4 К. Для металла (очищенного иодидным методом) после отжига модуль упругости 141000 МПа; пределы пропорциональности, текучести и прочности при растяжении соотв. 85, 118 и 220 МПа; твердость по Бринеллю 600 МПа; коэф. Пуассона 0,36; относит. удлинение 17–45%. В. пластичен, при нагр. на воздухе выше 300 °C становится хрупким. Примеси кислорода, водорода и азота резко снижают пластич. свойства В. и повышают его твердость и хрупкость.
3,4∙10−3 К−1 (273–373 К). В. парамагнитен, магн. восприимчивость массивного образца 5,48∙10−9. Стандартный электродный потенциал V2+/V° — 1,50 В. Температура перехода в сверхпроводящее состояние ниже 5,4 К. Для металла (очищенного иодидным методом) после отжига модуль упругости 141000 МПа; пределы пропорциональности, текучести и прочности при растяжении соотв. 85, 118 и 220 МПа; твердость по Бринеллю 600 МПа; коэф. Пуассона 0,36; относит. удлинение 17–45%. В. пластичен, при нагр. на воздухе выше 300 °C становится хрупким. Примеси кислорода, водорода и азота резко снижают пластич. свойства В. и повышают его твердость и хрупкость.
В. отличается высокой хим. стойкостью в морской воде, водных растворах минер. солей, довольно стоек к действию разб. соляной кислоты, не взаимод. на холоду с разб. HNO3 и H2SO4. Реагирует с фтористоводородной кислотой, концентрированными HNO3 и H2SO4, с царской водкой. Не взаимод. с растворами щелочей, но в расплавах щелочей в присутствии воздуха окисляется с образованием ванадатов. Кислород раств. в В., причем растворимость увеличивается с повышением температуры. При содержании кислорода до ~ 1% кристаллич. решетка В. остается кубической ( α-фаза), при больших содержаниях она перестраивается в тетрагональную (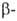 фаза), что, по-видимому, является осн. причиной сильного влияния кислорода на твердость В. При комнатной температуре β-фаза сохраняет гомогенность при содержании кислорода от 2,0 до 10,3%. При 600–700 °C происходит интенсивное окисление компактного металла до V2O5 (см. также ванадия оксиды).
фаза), что, по-видимому, является осн. причиной сильного влияния кислорода на твердость В. При комнатной температуре β-фаза сохраняет гомогенность при содержании кислорода от 2,0 до 10,3%. При 600–700 °C происходит интенсивное окисление компактного металла до V2O5 (см. также ванадия оксиды).
Выше 700 °C с N2 В. образует нитрид VN (желтые кристаллы, т. пл. 2360 °C), с углеродом и углеродсодержащими газами выше 800 °C — карбид VC (черные кристаллы, т. пл. ок. 2830 °C, микротвердость 20900 МПа), с Cl2 — хлориды и оксохлориды, с F2 — фториды и оксофториды (см. ванадия галогениды), с H2 — твердые растворы (растворимость H2 в 100 г В. 122,6 см3). С металлами В. дает сплавы и интерметаллич. соединения. Ниже приводятся сведения о других соед. этого элемента.
Галлид (галлид триванадия) V3Ga — светло-серые кристаллы; не раств. в воде и органических растворителях. Получают его взаимод. V с Ga или галлиевой бронзой при 1300 °C, хим. осаждением из газовой фазы с использованием VC14 и GaCl3 в присутствии H2. Сверхпроводник с критич. температурой 16,8 К; обладает высокой плотностью тока в сильных магн. полях (до 1∙105 А/см2 при 18 Тл). Применяют V3Ga при изготовлении обмоток соленоидов, кабелей для линий электропередачи, магнитов для магн. подвесок.
Диборид VB2 — серые кристаллы; т. пл. ок. 2400 °C; не раств. в воде и органических растворителях. Получают восстановлением оксидов V бором или В4С в вакууме при 1500–1600 °C, спеканием V и В. Компонент жаропрочных сплавов, огнеупорный материал.
Силицид (силицид триванадия) V3Si — светло-серые кристаллы; т. пл. 1910 °C (с разл.); не раств. в воде и органических растворителях. Получают его из V и Si конденсацией паров в вакууме или взаимод. в твердой фазе. Сверхпроводник с критич. температурой 17,2 К. Перспективен для использования в магн. системах электротехн. устройств.
Сульфид (пентасульфид диванадия) V2S5 — черные кристаллы; раств. в растворах сульфидов щелочных металлов с образованием красно-бурых растворов тиованадатов — М3VS4, MVS3, M4V2S7; получают взаимод. V2S3 с избытком S при 400 °C. Сесквисульфид V2S3 — черные кристаллы; при 1000 °C диссоциирует с образованием VS; получают при действии CS2 на V2O5, нагретый до 700 °C. Моносульфид VS — темно-коричневые кристаллы; получают нагреванием V2S3 в среде H2 при 850–1100 °C или сплавлением S с V2O5 при 400 °C в среде CO2.
О ванадиевых бронзах см. бронзы оксидные.
Получение. Осн. источник В. — ванадийсодержащие железные руды. При их обогащении получают концентраты, содержащие 60–67% Fe. Богатые В. концентраты (8–16%) в смеси с Na2CO3 или Na2SO4 окомковывают, а окатыши обжигают в окислит. среде при 800–1300 °C. При этом низшие оксиды Fe и V окисляются и образуются легкорастворимые ванадаты Na (V2O5 + Na2CO3 → 2NaVO3 + CO2), которые при водной обработке переходят в раствор. К последнему добавляют минер. кислоты (до pH 1,6–1,9) и нагревают до 90–95 °C. При этом в результате гидролиза ванадатов образуется осадок (хим. концентрат), который после удаления влаги содержит 92–95% V2O5, 4,5–7,5% Na2O и примеси др. оксидов. При осаждении в присутствии солей аммония содержание Na2O в осадке значительно меньше.
Концентраты с содержанием В. ок. 1% подвергают окомкованию и термич. упрочению (агломерации), а затем плавят в доменной печи. В. переходит в чугун, а при продувке последнего в конвертере воздухом или кислородом — в ванадиевый шлак (10–15% В.). Последний смешивают с Na2CO3, NaCl или CaCO3 и обжигают в окислит. среде при 750–900 °C. Обожженную шихту выщелачивают водой или разб. H2SO4. Из раствора, как и в предыдущем случае, выделяют хим. концентрат, содержащий после сушки до 92% V2O5.
Полученный по обоим способам хим. концентрат используют для выплавки феррованадия и др. сплавов. Феррованадий (35–80% В.) получают путем восстановления V2O5 ферросилицием или А1.
Значит. часть В. (в виде V2O5) получают в качестве побочного продукта при переработке фосфоритов, апатитов, патронитовых, карнотитовых, роскоэлитовых руд, бокситов, алунитов, медно-свинцово-цинковых и др. полиметаллич. руд, золы высокосернистых нефтей и нефтепродуктов, битуминозных сланцев. Патронитовые руды из-за большого содержания В. подвергают сначала окислит. обжигу, а затем восстановит. плавке в электропечах с получением феррованадия.
Металлич. В. высокой чистоты получают: восстановлением хлоридов В. (образуются при хлорировании феррованадия) водородом; кальциетермич. восстановлением V2O3 (образуется при восстановлении V2O5 водородом); магниетермич. восстановлением VC13; термич. диссоциацией VI2 (при этом получают металл наиб. высокой чистоты); электролизом расплавов галогенидов В. Чистота В. повышается (до 99,8–99,9%) после плавки в вакуумных электронно-лучевых печах или электрорафинирования.
Определение. Для обнаружения V(V) в растворе используют: реакцию с H2O2 в 20%-ной H2SO4 (красное окрашивание) или в щелочной среде (желтое окрашивание); восстановление в кислом растворе действием SO2, H2S, Fe2+ , спирта и др. (синее окрашивание); осаждение из слабокислого раствора сине-черного комплекса с таннином; образование вишнево-красного соед. Fe(II) при добавлении в солянокислый раствор FeCl3, диметилглиоксима и NH3; окрашивание раствора в красно-бурый цвет при добавлении (NH4)2S; осаждение белого осадка NH4VO3 при насыщении раствора NH4C1 или др. При совместном растирании образца, содержащего В., с 8-гидроксихинолином смесь окрашивается в желто-оранжевый цвет, который при нагр. переходит в густо-синий.
При количеств. определении В. образцы сплавляют с K2CO3 и Na2O2, а затем выщелачивают плав водой или разлагают кислотами. Для отделения В. от сопутствующих элементов его осаждают в виде ванадатов Ca, Ba, Hg, Pb, Ag, малые количества м. б. выделены аммиаком совместно с А1(OH)3 и Fe(OH)3. Используют также осаждение с (NH4)3H4[P(Mo2O7)6], 8-гидроксихинолином, бензоатом аммония и др. орг. реагентами, электролиз с ртутным катодом, экстракцию эфиром и отгонку В. в струе сухого HCl, ионный обмен. Гравиметрически В. определяют в виде V2O5. Наиб. достоверные результаты получают с помощью титриметрич. методов, заключающихся в предварит. восстановлении V(V) до V(IV) при действии SO2, FeSO4 и некоторых металлов и послед, титровании KMnO4. Распространен способ окисления В. KMnO4 с послед, титрованием раствором соли Fe(II). Используют также потенциометрич., фотометрич. (с H2O2) и др. методы. Получили применение физ. методы определения В.: эмиссионный спектральный, атомно-абсорбционный, нейтронно-активационный (с использованием короткоживущего изотопа 52V) и др.
Применение. В. в осн. (на 85%) используют как легирующую добавку для сталей, резко повышающую их прочность, сопротивление усталости и износоустойчивость. В. в сталях быстрее, чем др. элементы, взаимод. с растворенным С, образуя твердые и жаростойкие карбиды, которые, равномерно распределяясь в железе, способствуют образованию мелкокристаллич. структуры.
В. используют также для легирования чугуна, как компонент сплавов для постоянных магнитов, жаропрочных, твердых и коррозионностойких сплавов, а также в качестве конструкционного материала для ядерных реакторов. Добавки В. в золото повышают твердость последнего.
Мировое производство В. составляет ок. 25 тыс. т/год (1981). Важнейшие страны-производители: ЮАР (~ 45%), США (~19%), Чили (-3%), Финляндия, Норвегия.
Соединения В. токсичны. Они могут поражать органы дыхания, пищеварения, систему кровообращения и нервную систему, а также вызывать воспалит. и аллергич. заболевания кожи.
В качестве микроэлемента В. входит в состав микроорганизмов, животных и растений. Некоторые организмы, напр. асцидии, лишайники, избирательно концентрируют В.
Впервые В. был открыт в 1801 А. М. дель Рио. Однако позднее стали считать, что за новый элемент принят Cr. Лишь в 1830 существование В. было твердо установлено Н. Сефстрёмом и независимо от него Ф. Вёлером .
Лит.: Химия пятивалентного ванадия в водных растворах, Свердловск, 1971 (Труды института Химии УНЦ АН СССР, в. 24); Борисенко Л.Ф., Ванадий (минералогия, геохимия и типы эндогенных месторождений), М., 1973; Химия и технология редких и рассеянных элементов, под ред. К. А. Большакова, 2 изд., ч. 3, М., 1976, с. 3–37; Коган Б.И., Редкие металлы. Состояние и перспективы, М., 1979, с. 168–202; Слотвински й-Сидак Н. П., Андреев В. К., Ванадий в природе и технике, М., 1979; Аналитическая химия ванадия, М., 1981.
Б. Г. Коршунов
Значения в других словарях
- ванадий — -я, м. Химический элемент, твердый металл светло-серого цвета. [лат. Vanadium из др.-сканд.] Малый академический словарь
- Ванадий — (Vanadium) V, химический элемент V группы периодической системы Менделеева; атомный номер 23, атомная масса 50,942; металл серо-стального цвета. Природный... Большая советская энциклопедия
- ванадий — орф. ванадий, -я Орфографический словарь Лопатина
- ванадий — Вана́д/ий/. Морфемно-орфографический словарь
- ВАНАДИЙ — ВАНАДИЙ (символ V), ПЕРЕХОДНОЙ ЭЛЕМЕНТ, открытый в 1801 г. Серебристо-белый, ковкий, вязкий металл. Обнаружен в ЖЕЛЕЗНЫХ, СВИНЦОВЫХ И УРАНОВЫХ рудах, а также в угле и нефти. Используется в стальных сплавах для повышения прочности и жароустойчивости. Научно-технический словарь
- Ванадий — (Vanadium), V (a. vanadium; н. Vanadin; ф. vanadium; и. vanadio), — хим. элемент V группы периодич. системы Mенделеева, ат. н. 23, ат. масса 50,94. B природе известны два стабильных изотопа B. 50V (0,25%) и 51V (99,75%). Oткрыт мекс. минералогом A. M. Горная энциклопедия
- ванадий — ВАНАДИЙ -я; м. [лат. Vanadium из др.-сканд.] Химический элемент (V), твёрдый металл светло-серого цвета, используемый для изготовления ценных сортов стали. ● Назван так по имени древнескандинавской богини красоты Ванадис из-за красивого цвета своих солей. Толковый словарь Кузнецова
- ванадий — ВАНАДИЙ или ванад м. весьма редкий металл, похожий на серебро, и открытый в некоторых свинцовых рудах. Ванадокислый, химич. содержащий ванадовую кислоту. Толковый словарь Даля
- ванадий — [ < соб.] – хим. элемент, символ V, порядковый номер 23, атомный вес 50,95; серебристо-белый металл, твёрже кварца и стали; применяется при изготовлении ценных сортов стали; соединения ванадия применяются в резиновом, стекольном, красильном и др. производствах Большой словарь иностранных слов
- ванадий — ванадий м. Химический элемент, твёрдый металл светло-серого цвета, применяемый при изготовлении высокосортной стали, титановых сплавов и т.п. Толковый словарь Ефремовой
- ВАНАДИЙ — ВАНАДИЙ (лат. Vanadium) — V, химический элемент V группы периодической системы, атомный номер 23, атомная масса 50,9415. Название от имени древнескандинавской богини красоты Ванадис. Серо-стальной твердый металл. Плотность 6,11 г/см3, tпл 1920 °C. Большой энциклопедический словарь
- Ванадий — (хим. зн. V, атомн. вес 51) — химический элемент, сходный по соединениям с фосфором и азотом. Соединение В. нередко встречаются, хотя и в ничтожно малых количествах, в железных рудах и некоторых глинах; при обработке ванадистых руд железа... Энциклопедический словарь Брокгауза и Ефрона
