ванадия оксиды
ВАНАДИЯ ОКСИДЫ
Характеристики наиб. важных В. о. представлены в таблице. С увеличением степени окисления V усиливаются кислотные свойства оксидов, а также их хим. стойкость. Для многих В. о. характерны довольно широкие области гомогенности (см. табл. и рис.).
Монооксид VO не раств. в воде; с разб. неорг. кислотами образует бледно-голубые или фиолетовые растворы солей V(II). Сильный восстановитель. Получают восстановлением V2O5 водородом при 1700 °C. Гидроксид V(OH)2, образующийся при действии щелочей на раствор солей V(II), в индивидуальном виде не получен.
Сесквиоксид V2O3 существует в двух кристаллич. модификациях; при — 105 °C α-форма превращ. в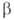 (
(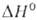 перехода 1,8 кДж/моль). α-Форма — антиферромагнетик, температура Нееля 168 К. В воде не раств.; с неорг. кислотами образует соли V(III). Сильный восстановитель. Получают восстановлением V2O5 оксидом углерода, H2, S и др. при нагревании. Применяют для получения ванадиевых бронз, как материал для термисторов. Встречается в природе в виде минерала карелианита. Гидроксид V(OH)3 образуется при действии щелочей или NH4OH на растворы солей V(III) без доступа воздуха.
перехода 1,8 кДж/моль). α-Форма — антиферромагнетик, температура Нееля 168 К. В воде не раств.; с неорг. кислотами образует соли V(III). Сильный восстановитель. Получают восстановлением V2O5 оксидом углерода, H2, S и др. при нагревании. Применяют для получения ванадиевых бронз, как материал для термисторов. Встречается в природе в виде минерала карелианита. Гидроксид V(OH)3 образуется при действии щелочей или NH4OH на растворы солей V(III) без доступа воздуха.
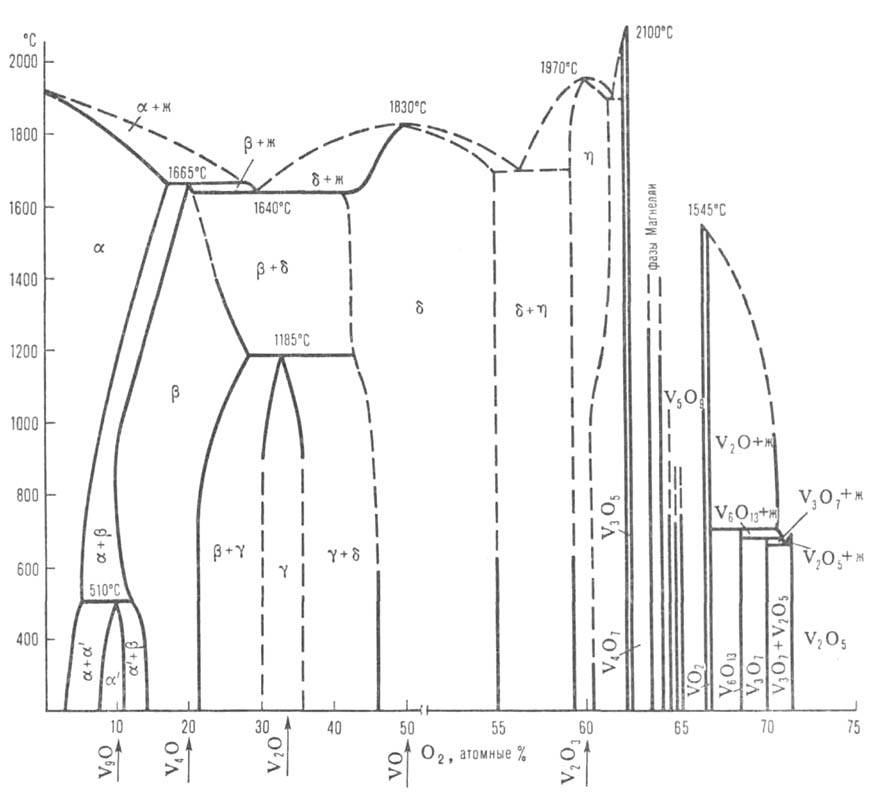
Диаграмма состояния системы ванадий-кислород: Ж-расплав; 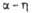 — твердые растворы (α-O2 в V;
— твердые растворы (α-O2 в V; 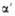 -на основе V9O;
-на основе V9O; 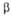 -на основе V4O;
-на основе V4O; 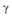 -на основе V2O;
-на основе V2O; 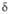 -на основе VO;
-на основе VO; 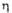 -на основе V2Oз); пунктирными линиями обозначены приблизительные границы фаз.
-на основе V2Oз); пунктирными линиями обозначены приблизительные границы фаз.
Пентаоксид триванадия V3O5 — антиферромагнетик, температура Нееля 270 К; при 430 К приобретает металлич. проводимость.
Диоксид VO2 существует в двух кристаллич. модификациях; при 68 °C α-форма превращ. в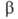 (
(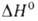 перехода 3,1 кДж/моль). α-Форма — антиферромагнетик, температура Нееля 345 К. Не раств. в воде. Гигроскопичен. Амфотерен: в кислых растворах образует катион ванадила VO2+ (раствор приобретает светло-синюю окраску), в щелочных дает ванадаты(IV) — соли не выделенной в своб. состоянии изополиванадиевой(IV) кислоты H2V4O9. Восстановитель. Окисляется на воздухе. Получают сплавлением V2O5 со щавелевой кислотой, нагреванием без доступа воздуха смеси V2O3 с V2O5, окислением V2O3. Применяют в производстве ванадиевых бронз, как полупроводниковый материал для термисторов, переключателей элементов памяти, дисплеев и др.
перехода 3,1 кДж/моль). α-Форма — антиферромагнетик, температура Нееля 345 К. Не раств. в воде. Гигроскопичен. Амфотерен: в кислых растворах образует катион ванадила VO2+ (раствор приобретает светло-синюю окраску), в щелочных дает ванадаты(IV) — соли не выделенной в своб. состоянии изополиванадиевой(IV) кислоты H2V4O9. Восстановитель. Окисляется на воздухе. Получают сплавлением V2O5 со щавелевой кислотой, нагреванием без доступа воздуха смеси V2O3 с V2O5, окислением V2O3. Применяют в производстве ванадиевых бронз, как полупроводниковый материал для термисторов, переключателей элементов памяти, дисплеев и др.
Оксигидроксид VO(OH)2 — розовые кристаллы; осаждается из растворов при pH > 4. Амфотерен.
Пентаоксид диванадия V2O5 выше 700 °C диссоциирует. Диамагнетик. Полупроводник n-типа; ширина запрещенной зоны ~ 2,5 эВ. Растворимость в воде 0,35 г/л при 25 °C; в водных растворах существует в виде изополиванадиевой(V) кислоты вероятного состава H2[O(V2O5)2,5]. B кислых растворах вероятные — формы существования V(V) — ионы VO2+ и VO3+. При нагр. таких растворов (pH 1–2) выделяются гидраты переменного состава V2O5*xH2O. В щелочных растворах образуются ванадаты(V). О производстве технического V2O5 см. ванадий. Чистый V2O5 получают разложением NH4VO3 при 400–500 °C с послед. выдержкой в струе O2, гидролизом VOCl3. Пентаоксид — промежут. продукт в производстве феррованадия, ванадия, ванадатов и др. соед. V; катализатор при получении H2SO4; компонент спец. стекол, глазурей и люминофоров красного свечения. Встречается в природе в виде минерала щербинаита.
СВОЙСТВА ОКСИДОВ ВАНАДИЯ
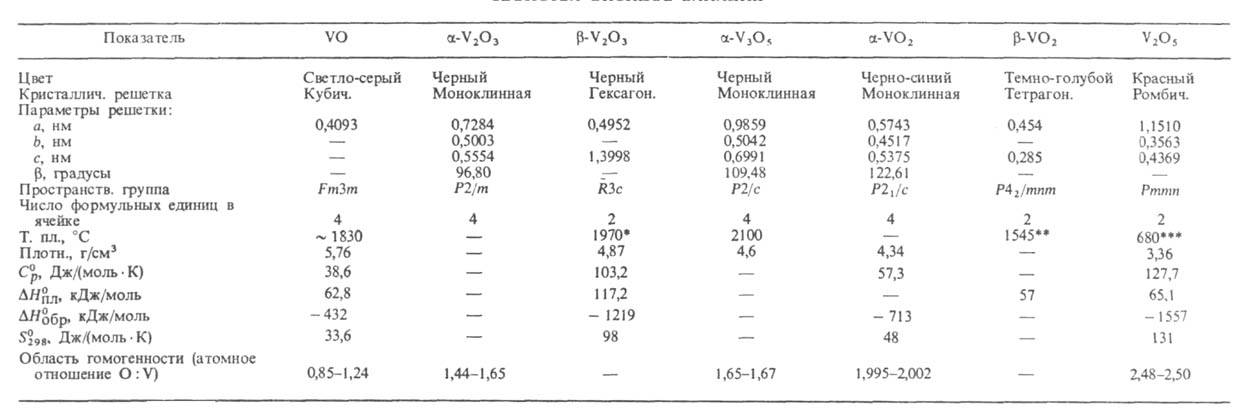
* Т. кип. ~ 3000 °C (с разл.). ** Т. кип. ~ 2000 °C (с разл.). *** Т. кип. ~ 2030 °C (с разл.)
Известны пять В. о., образующих гомологич. ряд VnO2n-1 (фазы Магнелли), где и = 4–8. Представляют собой черные кристаллы с триклинной решеткой. Обладают металлич. проводимостью при низких температурах (кроме V7O13). Антиферромагнетики. М. б. использованы как полупроводниковые материалы для терморезисторов. Ванадий образует также оксиды V3O7 и V6O13 — черные кристаллы с моноклинной решеткой, плавящиеся инконгруэнтно: первый — при 660–680 °C с образованием V6O13, второй — при 700–710 °C с образованием VO2. В. о. токсичны. Для V2O5 ПДК 0,1 мг/м3 (дым), 0,5 мг/м3 (пыль).
Лит.: Плетнев Р.Н., Губанов В.А., Фотиев А.А., ЯМР в оксидных соединениях ванадия, М., 1979; Vanadiumoxide: Darstellung, Eigenschaften, Anwendung, В., 1983.
Я. Я. Слотвинский-Сидак
