ванадийорганические соединения
ВАНАДИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
содержат связь V—С. Формальные степени окисления V в В. с. — от 4–5 до −1. Многие B.C. легко окисляются даже следами O2 и гидролизуются парами воды. Исключения — соед., содержащие неск. таких электроноакцепторных групп, как CO, галогены, перфторорг. лиганды. Многие В. с. термически неустойчивы. Практич. применения В. с. пока не нашли. Карбонилсодержащие В. с. синтезируют действием CO на соед. V с орг. лигандами или замещением лигандов в гекса-карбонилванадии [V(CO)6]. С последней реакцией часто конкурирует восстановление парамагнитного соед. [V(CO)6] в диамагнитный анион [V(CO)6]−. Так, взаимод. с [V(CO)6] многих п- и донорных молекул L (напр., аминов, спиртов, альдегидов, эфиров) приводит к диспропорционированию V по схеме:
донорных молекул L (напр., аминов, спиртов, альдегидов, эфиров) приводит к диспропорционированию V по схеме:
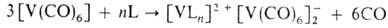
Замещение лигандов в анионе [V(CO)6]− для получения карбонилсодержащих В. с. используется редко, т. к. скорость этого процесса значительно ниже скорости аналогичных реакций нейтрального [V(CO)6]. Большое значение имеют реакции аниона [V(CO)6]− с галогенидами разл. металлов М, приводящие к образованию комплексов со связью V—М:
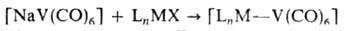
Среди карбонилсодержащих В. с. многочисленную группу составляют производные типа [V(CO)4L2], где L-арсин, фосфин, непредельный или ароматич. углеводород и др.
Наиб. изучены реакции тетракарбонил(циклопентадиенил)-ванадия [V(CO)4(C5H5)]: ацилирование с образованием [V(CO)4(C5H4COR)], замещение CO, напр. на ацетиленовые или диеновые (в т. ч. циклобутадиен) углеводороды, элементоорг. соед. (фосфины, арсины и др.); образование би- и полиядерных B.C., в частности [V2(CO)5(C5H5)2].
Среди В. с. с лигандами наиб. значение имеют ванадоцен [V(C5H5)2], или бис-(циклопентадиенил) ванадий, и его производные, которые получают взаимод. хлоридов V с циклопентадиенидом Na. К ним относятся [V(C5H5)2C12], [V(C5H5)2C1], [V(C5H5)2(
лигандами наиб. значение имеют ванадоцен [V(C5H5)2], или бис-(циклопентадиенил) ванадий, и его производные, которые получают взаимод. хлоридов V с циклопентадиенидом Na. К ним относятся [V(C5H5)2C12], [V(C5H5)2C1], [V(C5H5)2(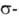 C5H5)]. Из первых двух соед. синтезируют др. производные, в т. ч. с
C5H5)]. Из первых двух соед. синтезируют др. производные, в т. ч. с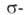 связями V—С.
связями V—С.
Циклопентадиенильные комплексы с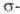 лигандами [V(C5H5)2R2], за исключением соед., в которых радикалами R служат группы CH3 и RC≡С, термически неустойчивы и уже при отрицат. температурах распадаются сначала до [VR(C5H5)2], а затем до [V(C5H5)2]. Действие на [VR(C5H3)2] электроф. реагентов (напр., HCl) или своб. радикалов приводит к разрыву
лигандами [V(C5H5)2R2], за исключением соед., в которых радикалами R служат группы CH3 и RC≡С, термически неустойчивы и уже при отрицат. температурах распадаются сначала до [VR(C5H5)2], а затем до [V(C5H5)2]. Действие на [VR(C5H3)2] электроф. реагентов (напр., HCl) или своб. радикалов приводит к разрыву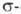 связи V—С. Циклопентадиенильные лиганды, как правило, не претерпевают изменений и не отщепляются. Реакции с их участием немногочисленны.
связи V—С. Циклопентадиенильные лиганды, как правило, не претерпевают изменений и не отщепляются. Реакции с их участием немногочисленны.
Координационно ненасыщенный электронодефицитный ванадоцен [V(C5H5)2] может внедряться по кратным связям углерод-углерод и углерод-азот, по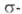 связям металл—металл и металл—углерод металлоорг. соед., вступать в реакции окислит. присоединения с такими реагентами, как алкилгалогениды, галогены, галогеноводороды.
связям металл—металл и металл—углерод металлоорг. соед., вступать в реакции окислит. присоединения с такими реагентами, как алкилгалогениды, галогены, галогеноводороды.
Известны 4 осн. типа B.C. с ареновыми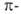 лигандами: [V(арен)2], [V(арен)2]+, [V(арен)(CO)4] и [V(арен)(CO)3Hal]. Бисареновые комплексы получают обычно из галогенидов V действием сильных восстановителей в присутствии соответствующих лигандов, моноаренкарбонильные комплексы — замещением CO в [V(CO)6].
лигандами: [V(арен)2], [V(арен)2]+, [V(арен)(CO)4] и [V(арен)(CO)3Hal]. Бисареновые комплексы получают обычно из галогенидов V действием сильных восстановителей в присутствии соответствующих лигандов, моноаренкарбонильные комплексы — замещением CO в [V(CO)6].
В. с. с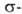 связями металл—лиганд получают обменными реакциями между галогенидами V или VO2+ и орг. соед. Li, Mg, Zn или А1. Все они термически неустойчивы (относительно стабильны комплексы R3V или R4V с такими крупными радикалами, как триметилсилилметил, камфенил, мезитил). Наиб. распространены комплексы, в которых V связан
связями металл—лиганд получают обменными реакциями между галогенидами V или VO2+ и орг. соед. Li, Mg, Zn или А1. Все они термически неустойчивы (относительно стабильны комплексы R3V или R4V с такими крупными радикалами, как триметилсилилметил, камфенил, мезитил). Наиб. распространены комплексы, в которых V связан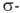 связями как с орг. лигандами, так и с атомами галогенов, кислорода или кислородсодержащими соединениями. Для всех
связями как с орг. лигандами, так и с атомами галогенов, кислорода или кислородсодержащими соединениями. Для всех производных характерно образование аддуктов с молекулами сольватирующих растворителей или избытком металлоорг. соединения.
производных характерно образование аддуктов с молекулами сольватирующих растворителей или избытком металлоорг. соединения.
Лит.: Методы элементоорганической химии. Подгруппы меди, скандия, титана, ванадия, хрома, марганца. Лантаноиды и актиноиды, под общ. ред. А. Н. Несмеянова и К. А. Кочешкова, т. 1, М., 1974.
Д. А. Лемеповский
